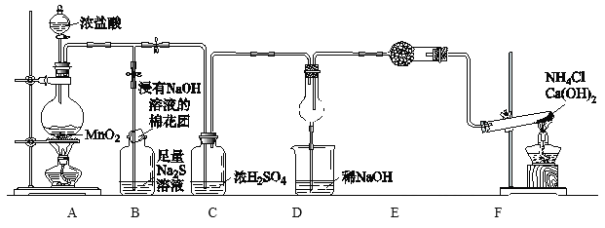
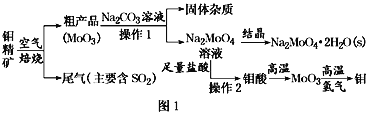
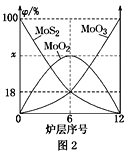
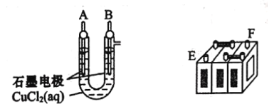
题目内容
【题目】下列说法错误的是
A. 0.1mol/L的Na2CO3溶液加适量水稀释后,溶液中![]() 变大
变大
B. 若使Na2S溶液中![]() 接近于2︰1,可加入适量的KOH固体
接近于2︰1,可加入适量的KOH固体
C. 25℃时,浓度均为0. 1mol/L NaOH和NH3·H2O混合溶液中c(OH- )>c(Na+ )=c(NH3·H2O)
D. 0.2 mol/L CH3COOH溶液与0. 1mol/L NaOH溶液等体积混合:2c(H+)-2c(OH -)=c(CH3COO-)-c(CH3COOH)
【答案】C
【解析】
A. Na2CO3溶液加适量水稀释后,促进水解,所以氢氧根离子浓度变大,碳酸根离子浓度减小,所以溶液中![]() 变大,则
变大,则![]() 变大,所以A选项是正确的;
变大,所以A选项是正确的;
B、适量KOH固体,水解平衡向着逆向移动,使得S2-的物质的量增大,而钠离子的物质的量不变,从而可使Na2S溶液中![]() 接近于2:1,所以B选项是正确的;
接近于2:1,所以B选项是正确的;
C、混合溶液中,氢氧化钠和一水合氨的混合比例未知,故无法判断c(Na+)= c(NH3·H2O),故C错误;
D、0.2 mol/L CH3COOH溶液与0. 1mol/L NaOH溶液等体积混合后,得到等物质的量浓度的醋酸和醋酸钠的混合溶液,根据物料守恒:2c(Na+)=c(CH3COO-)+c(CH3COOH),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因此可得:2c(H+)-2c(OH -)=c(CH3COO-)-c(CH3COOH),所以D选项是正确的。
故选C。

练习册系列答案
相关题目