题目内容
5.关于10mL 0.1mol•L-1的NH3•H2O溶液,下列说法正确的是( )| A. | 25℃时,若溶液的pH=11,则Kb(NH3•H2O)=1×10-6 | |
| B. | 向溶液中加入少量CH3COONa固体,溶液中$\frac{c(N{H}_{3}.{H}_{2}O)}{c(N{H}_{4}^{+})}$的值变小 | |
| C. | 向溶液中加入10 mL 0.1 mol•L-1盐酸,所得溶液中离子浓度大小顺序为:c(NH4+)>(Cl-)>c(H+)>c(OH-) | |
| D. | 向溶液中加入5 mL 0.1 mol•L-1盐酸,所得溶液中离子的浓度一定符合:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
分析 A.根据Kb(NH3•H20)=$\frac{c(N{{H}_{4}}^{+})•c({H}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=进行计算;
B.向溶液中加入少量CH3COONa固体,水解呈碱性,抑制NH3•H20的电离;
C.向溶液中加入10mL 0.1 mol•L-1HCl,得到NH4Cl溶液,NH4+部分水解,则c(Cl-)>c(NH4+);
D.根据混合液中的电荷守恒判断.
解答 解:A.25℃时,若溶液的pH=11,氢氧根离子浓度为10-3mol/L,则:Kb(NH3•H20)=$\frac{c(N{{H}_{4}}^{+})•c({H}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$mol•L-1=1×10-5 mol•L-1,故A错误;
B.向溶液中加入少量CH3COONa固体,醋酸根离子部分水解呈碱性,抑制了NH3•H20的电离,溶液中一水合氨浓度增大、铵根离子浓度减小,则$\frac{c(N{H}_{3}.{H}_{2}O)}{c(N{H}_{4}^{+})}$的值变大,故B错误;
C.向溶液中加入10mL 0.1 mol•L-1HCl,二者恰好反应生成NH4Cl,NH4+部分水解,则c(Cl-)>c(NH4+),正确的离子浓度大小为:(Cl-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D.向溶液中加入5 mL 0.1 mol•L-1盐酸,溶液中一定遵循电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),故D正确;
故选D.
点评 本题考查离子浓度大小的比较,题目难度中等,试题侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握弱电解质的电离特点以及影响因素,结合电荷守恒解答该题.

| A. | R的原子半径在五种原子中最大 | |
| B. | Y的氢化物的稳定性比W的强 | |
| C. | X与Y形成的化合物只有一种 | |
| D. | R的最高价氧化物的水化物的酸性比W的弱 |
| A. | 单质铜与稀硝酸反应:Cu+2 H++2NO3-═Cu2++2 NO↑+H2O | |
| B. | NaOH溶液与足量的Ca(HCO3)2溶液反应:2HCO3-+2OH-+Ca2+═CaCO3↓+2H2O | |
| C. | 等物质的量的FeBr2和Cl2在溶液中的反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 氨水吸收少量的二氧化硫:2NH3•H2O+SO2═2NH4++SO32-+H2O |
| A. | pH=3 | B. | c(H+)=5×10-5mol/L | ||
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=6 | D. | c(OH-)=10-12mol/L的溶液 |
| A | B | C | D | |
| X | SO2 | Cl2 | HCl | NO2 |
| Y | NaHCO3 溶液 | 饱和Na2SO3溶液 | 饱和NaCl溶液 | 水 |
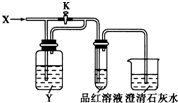
| A. | A | B. | B | C. | C | D. | D |
| A. | 生成了一种强酸弱碱盐 | B. | 弱酸溶液和强碱溶液反应 | ||
| C. | 强酸溶液和弱碱溶液反应 | D. | 一元强酸溶液和一元强碱溶液 |
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
 .
.