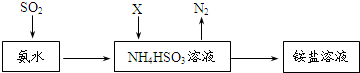
题目内容
9.下列关于25℃的NaHCO3溶液的相关事实,能够证明H2CO3为弱酸的是( )| A. | 溶液中存在CO32- | B. | 溶液中c(Na+)>c(CO32-) | ||
| C. | 与等物质的量的NaOH恰好中和 | D. | 溶液中c(H+)•c(OH-)=10-14 |
分析 弱酸属于弱电解质,在溶液中部分电离,存在电离平衡,据此分析.
解答 解:A.溶液中存在CO32-,说明NaHCO3发生电离,但不一定是部分电离,所以不能证明H2CO3为弱酸,故A错误;
B.溶液中c(Na+)>c(CO32-),说明HCO3-的电离为部分电离,所以能够证明H2CO3为弱酸,故B正确;
C.与等物质的量的NaOH恰好中和,说明NaHCO3能电离出氢离子,但不一定是部分电离,所以不能证明H2CO3为弱酸,故C错误;
D.25℃的溶液中均存在c(H+)•c(OH-)=10-14,与H2CO3的酸性强弱无关,故D错误.
故选B.
点评 本题考查了弱电解质的电离,题目难度不大,注意把握弱电解质在溶液中部分电离的特点.

练习册系列答案
相关题目
19.重铬酸钾(K2Cr2O7)俗称红矾钾,是工业生产和实验室的重要氧化剂.
已知K2Cr2O7溶液中存在平衡Cr2O72-+H2O?2CrO42-+2H+.
回答下列问题(残留在溶液中的离子浓度小于1×10-5 mol•L-1时,该离子视为沉淀完全):
(1)重铬酸钾试剂标签上应标注(图1)A.(填字母编号)
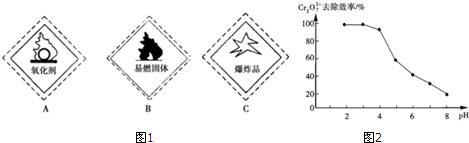
(2)加热时,重铬酸钾与浓盐酸反应,使氯离子氧化逸出,请写出该反应的离子方程式:14H++Cr2O72-+6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
(3)已知AgCl、Ag2CrO4(砖红色)的Ksp分别为2×10-10和1.12×10-12.分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定.滴定过程中首先析出沉淀AgCl,达到滴定终点的实验现象为:滴最后一滴AgNO3溶液时,生成砖红色沉淀.该沉淀滴定需要注意两个问题:
①指示剂的用量,滴定终点时,溶液中的CrO42-浓度为2.8×10-3 mol•L-1时合适;
②控制溶液的酸度,pH在6.5-10.5之间,请结合反应方程式分析,为什么pH<6.5实验结果将不准确:2CrO42-+2H+ Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
(4)人体内铬元素的含量过高,会引起急性中毒,甚至致癌.工业上可采用铁作阳极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Fe(OH)3和Cr(OH)3沉淀,从而使废水中铬含量低于排放标准.下表是常温下金属氢氧化物的Ksp和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度)[Cr(OH)3是一种两性氢氧化物].
①阴极的电极反应式为2H++2e-=H2↑;Cr2O72-转化为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O,电路中每转移6mol电子,最多有0.5mol Cr2O72-被还原.
②pH对废水中Cr2O72-去除效率的影响情况如图2所示.电解过程中对降低废水中的铬含量最有利的pH范围为4.3~5.6.
已知K2Cr2O7溶液中存在平衡Cr2O72-+H2O?2CrO42-+2H+.
回答下列问题(残留在溶液中的离子浓度小于1×10-5 mol•L-1时,该离子视为沉淀完全):
(1)重铬酸钾试剂标签上应标注(图1)A.(填字母编号)

(2)加热时,重铬酸钾与浓盐酸反应,使氯离子氧化逸出,请写出该反应的离子方程式:14H++Cr2O72-+6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
(3)已知AgCl、Ag2CrO4(砖红色)的Ksp分别为2×10-10和1.12×10-12.分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定.滴定过程中首先析出沉淀AgCl,达到滴定终点的实验现象为:滴最后一滴AgNO3溶液时,生成砖红色沉淀.该沉淀滴定需要注意两个问题:
①指示剂的用量,滴定终点时,溶液中的CrO42-浓度为2.8×10-3 mol•L-1时合适;
②控制溶液的酸度,pH在6.5-10.5之间,请结合反应方程式分析,为什么pH<6.5实验结果将不准确:2CrO42-+2H+
 Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.(4)人体内铬元素的含量过高,会引起急性中毒,甚至致癌.工业上可采用铁作阳极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Fe(OH)3和Cr(OH)3沉淀,从而使废水中铬含量低于排放标准.下表是常温下金属氢氧化物的Ksp和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度)[Cr(OH)3是一种两性氢氧化物].
| 金属离子 | Ksp | pH(10-1 mol•L-1) | pH(10-5 mol•L-1) |
| Fe3+ | 4.0×10-38 | 2.7 | 3.7 |
| Cr3+ | 6.0×10-31 | 4.3 | 5.6 |
②pH对废水中Cr2O72-去除效率的影响情况如图2所示.电解过程中对降低废水中的铬含量最有利的pH范围为4.3~5.6.
20.下列叙述正确的是( )
| A. | SO32-中硫原子的杂化方式为sp3 | B. | H2O分子中氧原子的杂化方式为sp2 | ||
| C. | BF3分子呈三角锥体空间型 | D. | C2H2分子中含有3个σ键和2个π键 |
4.分子式为C4H9ClO的有机物,能与金属钠反应放出氢气的同分异构体数目有( )
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
14.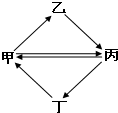 下列各组物质按如图所示转化关系每一步都能一步实现的是
下列各组物质按如图所示转化关系每一步都能一步实现的是
( )
 下列各组物质按如图所示转化关系每一步都能一步实现的是
下列各组物质按如图所示转化关系每一步都能一步实现的是| 甲 | 乙 | 丙 | 丁 | |
| A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
| B | Cu | CuO | CuSO4 | CuCl2 |
| C | C | CO | CO2 | H2CO3 |
| D | NH3 | NO | NO2 | HNO3 |
| A. | A | B. | B | C. | C | D. | D |
1.关于如图所示实验的说法不正确的是( )
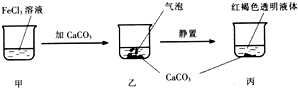

| A. | 乙中产生的气泡是C02 | |
| B. | 丙中液体可产生丁达尔现象 | |
| C. | 若忽略溶液体积的变化,烧杯中c(Cl-)不发生变化 | |
| D. | 若将CaC03换成CaS04也可得到相同的实验现象 |
18.下列关于实验现象解释不正确的是( )
| A | B | C | D | |
| 操作与现象 | 放在石棉网上的钠在空气中燃烧生成黑色固体 | 铜与稀硝酸反应试管内产生红棕色气体 | 0.5mol/L的CaCl2滴入0.5mol/L的NaHCO3中产生白色沉淀 | Cu与浓硫酸反应生成白色及少量黑色沉淀物 |
| 解释 | 生成固体物质有大量的碳 | 反应产生的NO与试管内的空气反应 | 反应2HCO3-+Ca2+=CaCO3↓+H2O+CO2↑ | 白色沉淀是CuSO4黑色沉淀是Cu2O |
| A. | A | B. | B | C. | C | D. | D |
17.下列说法正确的是( )
| A. | 等质量的硫蒸汽和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | 由C(金刚石)═C(石墨)△H=-1.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | NH3的稳定性强,是因为其分子之间存在氢键 |