题目内容
【题目】下列反应的离子方程式正确的是
A.碳酸钠的水解反应CO32-+H2O=HCO3-+OH -
B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.苯酚钠溶液与二氧化碳反应C6H5O-+CO2+H2O=C6H5OH+CO32-
D.稀硝酸与过量的铁屑反应3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
【答案】B
【解析】
A.碳酸钠溶液中CO32-水解程度很小,存在化学平衡,水解反应CO32-+H2O![]() HCO3-+OH-,A错误;
HCO3-+OH-,A错误;
B.碳酸氢钙与过量的NaOH溶液反应,产生CaCO3沉淀、Na2CO3、H2O,反应的离子方程式为:Ca2++2HCO3-+2OH-=CaCO3↓+ 2H2O+CO32-,B正确;
C.苯酚钠溶液与二氧化碳反应,产生苯酚、NaHCO3,反应方程式为C6H5O-+ CO2+H2O=C6H5OH+HCO3-,C错误;
D.稀硝酸与过量的铁屑反应产生Fe2+,3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,D错误;
故合理选项是B。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】I.SO2是一种重要的化工原料,其合理利用以及废气处理一直是化工研究的热点。
(1)氧元素在元素周期表中位于第______周期______族,硫原子核外有_____种能量不同的电子。
(2)元素的非金属性S比O______(填“强”或“弱”),从原子结构的角度解释原因:__________。
II.工业上利用反应SO2 + MnO2 → MnSO4 可以制备高纯 MnSO4,实验装置如下图:

(3)请标出反应SO2 + MnO2 → MnSO4的电子转移方向和数目____________
(4)在通入干燥空气的条件下,一段时间后,测得反应后溶液中的 n(SO42-)明显大于 n(Mn2+),请说明原因: ___________________。用化学方程式表示石灰乳的作用: ___________________。
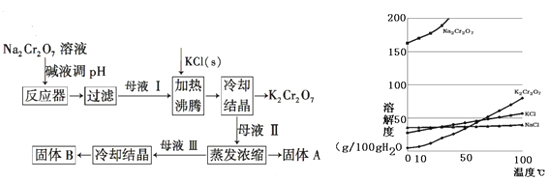
III.SO2可用于处理含 Cr2O72-(铬元素化合价为+6)的废水,最后转化为铬沉淀(铬元素化合价为+3)除去。一种处理流程如下:
![]()
(5)NaHSO3与 Cr2O72-反应时,物质的量之比为__________。
【答案】 二 ⅥA 5 弱 硫原子半径大于氧原子半径,硫原子和氧原子的最外层电子数相等,硫原子的得电子能力比氧原子弱  在溶液中,空气中的氧气将二氧化硫氧化为 H2SO4 SO2+ Ca(OH)2→CaSO3+ H2O(或2SO2+2Ca(OH)2+O2→ 2CaSO4 + 2H2O) 3∶1
在溶液中,空气中的氧气将二氧化硫氧化为 H2SO4 SO2+ Ca(OH)2→CaSO3+ H2O(或2SO2+2Ca(OH)2+O2→ 2CaSO4 + 2H2O) 3∶1
【解析】试题分析:(1)氧原子核外有2个电子层,最外层有6个电子,硫原子核外电子排布式是1S22S22P63S23P4;(2)同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强;(3)反应SO2 + MnO2 → MnSO4中,硫元素化合价由+4升高为+6,锰元素化合价由+4降低为+2;(4)氧气能把二氧化硫氧化为 H2SO4;二氧化硫污染空气,用氢氧化钙能吸收二氧化硫;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,根据化合价升降相同计算物质的量之比。
解析:(1)氧原子核外有2个电子层,最外层有6个电子,所以氧元素在元素周期表中位于第二周期ⅥA族,硫原子核外电子排布式是1S22S22P63S23P4,有5个能级,所以有5种能量不同的电子;(2) 同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强,所以S非金属性比O弱;(3)反应SO2 + MnO2 → MnSO4中,硫元素化合价由+4升高为+6,硫失去2个电子,锰元素化合价由+4降低为+2,锰元素得到2个电子,所以电子转移方向和数目是 ;(4)氧气能把二氧化硫氧化为 H2SO4,所以反应后溶液中的 n(SO42-)明显大于 n(Mn2+);二氧化硫污染空气,氢氧化钙能吸收二氧化硫,反应方程式为SO2+ Ca(OH)2→CaSO3+ H2O;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,设NaHSO3与 Cr2O72-反应时的物质的量比为x∶y,根据化合价升降相同,2x=y×2×3,所以x∶y= 3∶1。
;(4)氧气能把二氧化硫氧化为 H2SO4,所以反应后溶液中的 n(SO42-)明显大于 n(Mn2+);二氧化硫污染空气,氢氧化钙能吸收二氧化硫,反应方程式为SO2+ Ca(OH)2→CaSO3+ H2O;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,设NaHSO3与 Cr2O72-反应时的物质的量比为x∶y,根据化合价升降相同,2x=y×2×3,所以x∶y= 3∶1。
点睛:氧化还原反应中,氧化剂得电子化合价降低,还原剂失电子化合价升高,根据氧化还原反应的升降规律,氧化剂得电子数一定等于还原剂失电子数。
【题型】综合题
【结束】
22
【题目】I.工业上可由氢气、氮气合成氨气,溶于水形成氨水。盐酸和氨水是实验室常见的电解质溶液。一定温度下,向2L 密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。
2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。

(1)0~2 min 内的平均反应速率 v(H2)=___________。
(2)该温度下,反应 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
T/ ℃ | 25 | 125 | 225 |
平衡常数 K | 4×106 | K1 | K2 |
试判断K1________K2(填写“>”“=”或“<”)。
(3)下列能说明合成氨反应已达到平衡状态的是______(填字母)(反应是在固定体积的密闭容器中进行的)
a.3v(N2) = v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
II.常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表。
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液 pH |
① | 0. 2 | 0.2 | pH=x |
② | c | 0.2 | pH=7 |
请回答:
(4)①中所得混合溶液, pH_______7(填“>”“<”或“=”)。
②中 c___0.2(填“>”“<”或“=”),所得混合溶液中各离子浓度大小关系为_____________。
(5)请你再设计一个能证明一水合氨是弱电解质的方案。_____________。
【题目】将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
1 | 100 | 17.2 | 2.24 |
2 | 200 | 8.00 | 4.48 |
3 | 400 | 0 | V |
下列说法正确的是( )
A. 表中V=7.84 L
B. 原混合物粉末的质量为25.6 g
C. 原混合物粉未中铁和铜的物质的量之比为2:3
D. 实验3所得溶液中硝酸的物质的量浓度为0.875 molL﹣1
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是______。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.单质的熔点降低
d.氧化物对应的水化物碱性减弱,酸性增强
原子最外层电子数与次外层电子数相同的元素名称为_____,氧化性最弱的简单阳离子是____。
(2)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是_____;制铝时,电解Al2O3而不电解AlCl3的原因是_____。
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:_____;
(4)下列气体不能用浓硫酸干燥,可用P2O5干燥的是_____。
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:____。