题目内容
1.我国濒临海域的省份,能够充分利用海水制得多种化工产品.如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中E是一种化肥,N是一种常见的金属单质.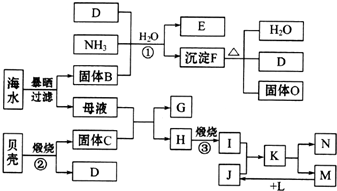
结合上述工艺流程图回答下列问题:
(1)物质G和L的化学式分别为CaCl2和H2.
(2)上述工艺流程图中可以循环使用的物质的化学式为CO2.
(3)反应①的化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;在反应①中必须先通入NH3,而后通入D,其原因是NH3在溶液中的溶解度大,利于吸收CO2,使其转化为NH4HCO3.
(4)工业上利用F可制得另一种化工产品,该反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(5)由K溶液经如何处理才能制得N?MgCl2溶液必须在氯化氢气体中进行蒸发结晶制得无水MgCl2,电解熔融MgCl2可制取金属镁.
分析 贝壳主要成分是碳酸钙,煅烧生成二氧化碳和氧化钙,所以C是CaO,D是CO2.海水暴晒得到固体B为NaCl,氯化钠、氨气和二氧化碳反应生成碳酸氢钠和氯化铵,为侯德邦制碱法,E是一种化肥,所以E是NH4Cl、F是NaHCO3,碳酸氢钠加热分解生成碳酸钠、二氧化碳与水,故O为Na2CO3.母液中主要成分是MgCl2,母液和CaO反应生成H和G,H煅烧得到I,则H为Mg(OH)2,G为CaCl2,I为MgO,N是一种常见金属单质,则N为Mg,电解熔融MgCl2得到Mg和Cl2,所以K为MgCl2,J为HCl,M是Cl2,氢气在氯气中燃烧得到HCl,所以L是H2,据此解答.
解答 解:贝壳主要成分是碳酸钙,煅烧生成二氧化碳和氧化钙,所以C是CaO,D是CO2.海水暴晒得到固体B为NaCl,氯化钠、氨气和二氧化碳反应生成碳酸氢钠和氯化铵,为侯德邦制碱法,E是一种化肥,所以E是NH4Cl、F是NaHCO3,碳酸氢钠加热分解生成碳酸钠、二氧化碳与水,故O为Na2CO3.母液中主要成分是MgCl2,母液和CaO反应生成H和G,H煅烧得到I,则H为Mg(OH)2,G为CaCl2,I为MgO,N是一种常见金属单质,则N为Mg,电解熔融MgCl2得到Mg和Cl2,所以K为MgCl2,J为HCl,M是Cl2,氢气在氯气中燃烧得到HCl,所以L是H2.
(1)由上述分析可知,物质G为CaCl2,L为H2,
故答案为:CaCl2;H2;
(2)煅烧贝壳时生成的气体CO2,及碳酸氢钠分解得到的CO2,可以在反应①中循环使用,
故答案为:CO2;
(3)反应①的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;在反应①中必须先通入NH3,而后通入D,其原因是:NH3在溶液中的溶解度大,利于吸收CO2,使其转化为NH4HCO3,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;NH3在溶液中的溶解度大,利于吸收CO2,使其转化为NH4HCO3;
(4)工业上加热碳酸氢钠分解制得碳酸钠,该反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(5)由MgCl2溶液经如何处理才能制得Mg的过程为:MgCl2溶液必须在氯化氢气体中进行蒸发结晶制得无水MgCl2,电解熔融MgCl2可制取金属镁,
故答案为:MgCl2溶液必须在氯化氢气体中进行蒸发结晶制得无水MgCl2,电解熔融MgCl2可制取金属镁.
点评 本题考查无机物推断,涉及海水资源的综合利用、联氨制碱法、金属的冶炼等,注意(3)中通入气体先后顺序、(5)中获取Mg单质的方法,属于易错知识点,难度中等.

| A. | c(OH-)=c(Na+)+c(H+) | |
| B. | 该溶液中的c(OH-)=1.0×10-3mol•L-1 | |
| C. | 加水稀释104倍所得溶液显碱性 | |
| D. | 与pH=3的HF溶液等体积混合所得溶液:c(Na+)=c(F-)+c(HF) |
| A. | 在醋酸溶液中,NH4+、Na+、SiO32-、C2O42-能大量共存 | |
| B. | 与Na2S2O3溶液反应的离子方程式:S2O32-+2H+═S↓+SO2↑+H2O | |
| C. | 常温下,加水稀释醋酸,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| D. | 该醋酸溶液中c(CH3COO-)<0.001 mol•L-1 |
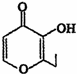 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | lmol该有机物最多能与2molH2发生加成反应 | |
| B. | 该有机物能发生取代、加成和氧化反应 | |
| C. | 该有机物的分子式为C7H6O3 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
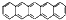 并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )
并五苯的荧光信号,该项工作被称为里程碑式的贡献.并五苯一氯取代物数目为( )| A. | 4 | B. | 6 | C. | 7 | D. | 11 |
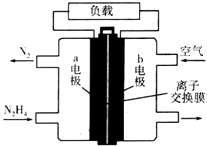 液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述不正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述不正确的是( )| A. | a极的反应式:N2H4+4OH--4e-═N2↑+4H2O | |
| B. | 放电时,电子从a极经过负载流向b极 | |
| C. | 该电池持续放电时,离子交换膜需选用阴离子交换膜 | |
| D. | 电路中转移电子3NA时消耗氧气16.8 L |
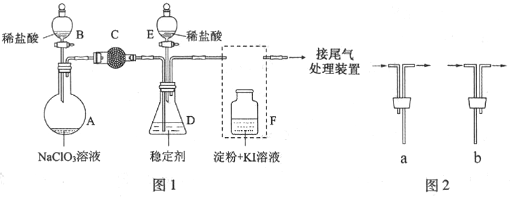
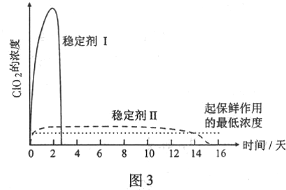
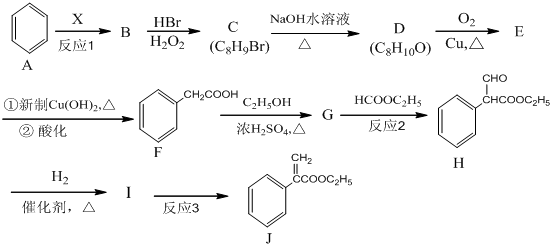
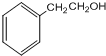 ,G的结构简式为
,G的结构简式为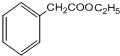 .
.

 +H2O.
+H2O.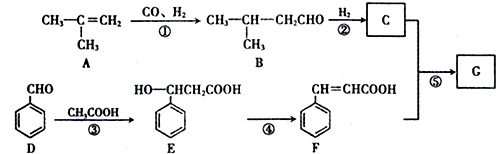
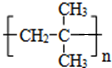 .
.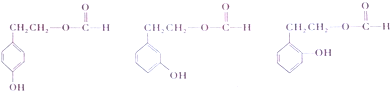 .
.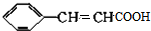 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$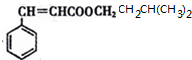 +H2O.
+H2O.