题目内容
9.在120℃时,1体积甲烷和丁烯的混合物与4体积O2在密闭容器中充分燃烧,只生成水和二氧化碳,反应后恢复到原温度,压强增加为原来的1.1倍,则混合气体中丁烯的体积分数是( )| A. | 20% | B. | 40% | C. | 50% | D. | 9 5% |
分析 120℃时,甲烷燃烧生成CO2和H2O(g),体积不变,则压强增大是由丁烯燃烧生成CO2和H2O(g)体积增大造成的,根据体积增加利用差量法计算出原混合气体中丁烯的体积,再根据体积分数定义计算混合气体中丁烯的体积分数.
解答 解:120℃时,甲烷燃烧生成CO2和H2O(g),通过方程式CH4+2O2═CO2+2H2O可以发现甲烷燃烧前后气体体积不发生变化,则压强增大是由丁烯燃烧生成CO2和H2O(g)体积增大造成的,
反应后恢复到原温度,压强增加为原来的1.1倍,则反应后总体积为5.5体积,C4H8+6O2═4CO2+4H2O所以压强变大就是丁烯的燃烧引起的,
C4H8+6O2═4CO2+4H2O…增加△V
1 1
x (5.5-5)体积=0.5体积
则:$\frac{1}{x}$=$\frac{1}{0.5体积}$,
解得:x=0.5体积,
所以混合气体中丁烯的体积分数为:$\frac{0.5体积}{1体积}$×100%=50%.
故选C.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握差量法在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
19.下列实验操作中,所用仪器合理的是( )
| A. | 用25mL的烧杯量取14.80mL NaOH溶液 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.20g NaCl | |
| D. | 用100mL容量瓶配制80mL 0.1mol/L的盐酸 |
20.配制250mL0.10mol•L-1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是( )
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 所用NaOH已经潮解 | |
| C. | 带游码的天平称2.4gNaOH时误用了“左码右物”方法 | |
| D. | 在容量瓶中进行定容时俯视刻度线 |
17.下列说法不正确的是( )
| A. | 能量的释放或吸收是以发生变化的物质为基础的,二者密不可分,但以物质为主,如果物质没有变化,就不能引发能量的变化 | |
| B. | 氢能的优点是燃烧热值高,资源丰富,无毒无污染,且便于储存和运输,因此很可能成为未来的主要能源 | |
| C. | 对于在给定条件下反应物之间能够同时发生多个反应的情况,理想的催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| D. | 离子反应的速率决定于溶液中离子的浓度和离子的扩散速率,受温度影响不大,是一类不需要活化能来引发的反应,所以反应速率很高 |
4.HM和HR的溶液分别加水稀释时pH变化如图.下列叙述中正确的是( )
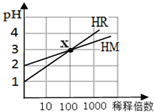

| A. | HR可能是弱酸 | B. | x点时c(R-)=c(M-) | ||
| C. | HM是一种强酸 | D. | 稀释前,c(HR)=10c(HM) |
14.下列说法中不正确的是( )
①将BaSO4放入水中不能导电,所以BaSO4是非电解质;
②氨溶于水得到的溶液能导电,所以氨水是电解质;
③固态的共价化合物不导电,熔融态的共价化合物可以导电;
④熔融的NaCl在电流作用下电离成Na+和Cl-;
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强;
⑥强电解质都是离子化合物,弱电解质都是共价化合物,
⑦强电解质的水溶液中不存在溶质分子.
①将BaSO4放入水中不能导电,所以BaSO4是非电解质;
②氨溶于水得到的溶液能导电,所以氨水是电解质;
③固态的共价化合物不导电,熔融态的共价化合物可以导电;
④熔融的NaCl在电流作用下电离成Na+和Cl-;
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强;
⑥强电解质都是离子化合物,弱电解质都是共价化合物,
⑦强电解质的水溶液中不存在溶质分子.
| A. | ①②③⑥ | B. | ①③⑤⑥⑦ | C. | ①②③④⑤⑥ | D. | 全部 |
18.对于下列反应的反应类型的判断,正确的是( )
| A. | CO2+H2O=H2CO3分解反应 | |
| B. | Cu(OH)2$\frac{\underline{\;△\;}}{\;}$CuO+H2O 化合反应 | |
| C. | Fe2O3+3CO$\frac{\underline{\;△\;}}{\;}$2Fe+3CO2 置换反应 | |
| D. | NaCl+AgNO3=AgCl↓+NaNO3复分解反应 |
19.下列物质中既能与强酸反应,又能与强碱反应,且都能生成盐和水的是( )
①Al ②Al2O3 ③Al(OH)3 ④Na2CO3.
①Al ②Al2O3 ③Al(OH)3 ④Na2CO3.
| A. | ①③ | B. | ②③④ | C. | ②③ | D. | 全部 |