题目内容
4.HM和HR的溶液分别加水稀释时pH变化如图.下列叙述中正确的是( )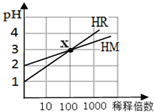
| A. | HR可能是弱酸 | B. | x点时c(R-)=c(M-) | ||
| C. | HM是一种强酸 | D. | 稀释前,c(HR)=10c(HM) |
分析 由图可知,HR开始的pH=1,稀释100倍pH=3,则HR为强酸,而HM开始的pH=2,稀释100倍pH=3,则HM为弱酸,并根据酸碱中和及电离来解答.
解答 解:A.HR开始的pH=1,稀释100倍pH=3,则HR为强酸,故A错误;
B.x点,两种溶液中氢离子浓度相等,根据电荷守恒知,c(H+)=c(R-),c(H+)=c(M-),所以c(R-)=c(M-),故B正确;
C.HM开始的pH=2,稀释100倍pH=3,则HM为弱酸,故C错误;
D.稀释前,c(HR)=0.1mol/L,c(HM)>0.01mol/L,则c(HR)<10c(HM),故D错误;
故选B.
点评 本题考查电解质在水中的电离及图象,明确图象中pH的变化及交点的意义是解答本题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.在新制饱和氯水中,若只改变某一条件,下列叙述正确的是( )
| A. | 再通入少量氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| B. | 加入少量的碳酸钠粉末,pH增大,溶液漂白性增强 | |
| C. | 加入少量固体NaOH,一定有c(Na+)═c( Cl-)+c(ClO- ) | |
| D. | 加入少量水,水的电离平衡向逆反应方向移动 |
15.有机物甲的结构简式如图,下列说法正确的是( )


| A. | 可用新制氢氧化铜悬溶液鉴别有机物甲、乙醇和甲酸乙酯 | |
| B. | 1mol该有机物可以消耗5molBr2 | |
| C. | 与稀H2SO4共热生成两种有机物 | |
| D. | 与NaOH溶液共热可消耗6molNaOH |
12.NO是一种性质活泼的大气污染物,它能与很多物质发生反应.
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$.已知K300°C >K350°C,则该反应是放热反应.
(2)图中表示NO2的变化的曲线是b.用O2表示从0-2 s内该反应的平均速率v=0.0015mol/(L•s).
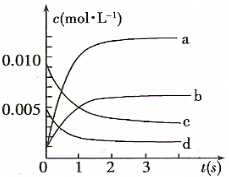
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度d.选择高效催化剂.
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.用O2表示从0-2 s内该反应的平均速率v=0.0015mol/(L•s).

(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度d.选择高效催化剂.
19.下列说法不正确的是( )
| A. | 在锌锰干电池中,锌电极是负极 | |
| B. | 手机上用的锂离子电池属于二次电池 | |
| C. | 甲醇燃料电池可把化学能转化为电能 | |
| D. | 铅蓄电池在放电过程中,负极质量减少,正极质量增加 |
9.在120℃时,1体积甲烷和丁烯的混合物与4体积O2在密闭容器中充分燃烧,只生成水和二氧化碳,反应后恢复到原温度,压强增加为原来的1.1倍,则混合气体中丁烯的体积分数是( )
| A. | 20% | B. | 40% | C. | 50% | D. | 9 5% |
14.某古玩爱好者收藏的“商代铝碗”在“鉴宝”时被专家当场否定,其理由是( )
| A. | 铝的性质较活泼,难提炼,商代不可能有铝制品 | |
| B. | 铝的质地较软,易变形,不宜做碗 | |
| C. | 铝元素易导致老年痴呆,不宜盛放食物 | |
| D. | 铝的导热性较强,不宜做碗 |
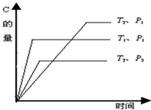 可逆反应2A(g)+nB(g)?mC(g)在温度分别为T1、T2,压强分别为P1、P2的条件下,测得C的量与时间的关系如图. 根据图分析,P1、P2的大小关系为P2>P1;反应式中系数m和n的关系是2+n<m;该反应的逆反应是放热反应.
可逆反应2A(g)+nB(g)?mC(g)在温度分别为T1、T2,压强分别为P1、P2的条件下,测得C的量与时间的关系如图. 根据图分析,P1、P2的大小关系为P2>P1;反应式中系数m和n的关系是2+n<m;该反应的逆反应是放热反应. .
.