��Ŀ����
����Ŀ�������ᣨHNO2��ΪһԪ���ᣬ���������������ơ���֪��298Kʱ���������ʵĵ���ƽ�ⳣ����K�����±���
HNO2 | NH3��H2O | H2CO3 | H2SO3 | |
K��mol��L-1��-2 | 5.1��10-4 | 1.8��10-5 | Ka1=4.2��10-7 Ka2=5.61��10-11 | Ka1=1.3��10��2 Ka2=6.3��10��8 |
(1)���в���˵��HNO2��������ʵ���_____��
a.������0.1 mol��L-1 NaNO2��Һ��pH��7
b.��һ��Ũ��HNO2��Һ������ʵ�飬���ݺܰ�
c.��pH��������������HNO2��Һ�ֱ�������п��Ӧ��HNO2�ų��������϶�
d.�����£�0.1mol��L-1 HNO2��Һ��pH=2.3
(2)298Kʱ����10mL 0.1mol��L-1����������Һ��10mL 0.1mol��L-1��ˮ��ϣ�������ҺΪ_____����������������������������������;298Kʱ����10mL pH=3����������Һ��10mL pH=11��ˮ��ϣ�������ҺΪ_____������������������������������������
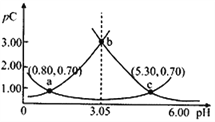
(3)����pH=2��HNO2��HCl����Һ�ֱ��ˮϡ�ͣ�pH�仯����ͼ��ʾ���ж�����I��Ӧ����ҺΪ_______���ѧʽ����ͼ��a��b��c�����Ӧ��Һ�ĵ���������ǿ������˳����_______����a��b��c��ʾ����ͬ������Һ��ˮ�ĵ���̶���ǿ������˳����__________��
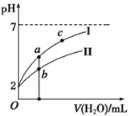
(4)�����ṩ���ݻش��������⡣
��NaH SO3��ˮ��Һ�еĵ��뷽��ʽΪ___________________��
��H 2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪ_________________��
���𰸡�b ���� ���� HCl b>a>c c > a > b NaHSO3=HSO3-��Na+ �� HSO3-![]() SO32- + H+ H2SO3��HCO3-=HSO3-��CO2����H2O
SO32- + H+ H2SO3��HCO3-=HSO3-��CO2����H2O
��������
(1)ֻ�в��ֵ���ĵ����Ϊ������ʣ�ֻҪ��˵�������Ჿ�ֵ����������������ܹ�ˮ�⣬����֤����������������ʣ��ݴ˷������
(2) ������ĵ���̶ȴ���һˮ�ϰ��ĵ���̶ȣ�笠����ӵ�ˮ��̶ȴ�������������ӵij̶ȣ�
(3) HNO2�����ᡢHCl��ǿ�ᣬ��ˮϡ��ʱHNO2�������룬ϡ����ͬ�ı���ʱc(H+)��HNO2��HCl����ϡ����ͬ����ʱpH�仯�ϴ�������ᡢ��С����HNO2����ͬ����������Ũ�ȴ���Һ�ĵ�����ǿ��������ˮ���룬����c(H+)Խ��������ˮ����̶�Խ��
(4)��NaHSO3�ǿ�����������ȫ���룬��HSO3-����̶Ƚ��������ֵ��룬���ڵ���ƽ�⣻
���ɱ������ݿ�֪������H 2SO3��HSO3-��H2CO3�����ǿ���������ԭ��д��������Ӧ�����ӷ���ʽ��
(1) a. ����ʱNaNO2��Һ��pH����7��˵������������ǿ�������Σ������������ˮ���ʹ����Һ�ʼ��ԣ��������Ჿ�ֵ��룬Ϊ������ʣ���a��ȷ��b. ��HNO2��Һ������ʵ�飬���ݺܰ���˵����Һ������Ũ�Ƚϵͣ�������ˮ�������Ჿ�ֵ��룬���Բ���֤����������������ʣ���b����c.��pH��������������HNO2��Һ�ֱ�������п��Ӧ��HNO2�ų��������϶࣬�������д��ڲ��ֵ��룬������֤����������������ʣ���c��ȷ��d. ������0.1molL-1��HNO2��ҺpH=2.3��˵�������Ჿ�ֵ��룬Ϊ������ʣ���d��ȷ���ʴ�Ϊb��
(2) ��֪��25��ʱ��һˮ�ϰ���Ki=1.8��10-5��������ĵ���ƽ�ⳣ��Ki=5.1��10-4������������ĵ���̶ȴ���һˮ�ϰ��ĵ���̶ȣ���笠����ӵ�ˮ��̶ȴ�������������ӵij̶ȣ���298Kʱ����10mL 0.1mol��L-1����������Һ��10mL 0.1mol��L-1��ˮ��ϣ�ǡ������NH4NO2��Һ��������˭ǿ��˭������������Һ�����ԣ�����10mL pH=3����������Һ��10mL pH=11��ˮ��ϣ�������˭����˭������������ҺΪ���ԣ�
(3) HNO2�����ᡢHCl��ǿ�ᣬ��ˮϡ��ʱHNO2�������룬ϡ����ͬ�ı���ʱc(H+)��HNO2��HCl����ϡ����ͬ����ʱpH�仯�ϴ����HCl����С����HNO2������ͼ֪I��Ӧ����ҺΪHCl��������ˮ���룬����c(H+)Խ������Һ�ĵ�����Խǿ��������ˮ����̶�Խ��c(H+)��b��a��c������Һ�ĵ����ԣ�b>a>c��ˮ�ĵ���̶ȣ�c��a��b��
(4)��NaHSO3�ǿ�����������ȫ���룬��HSO3-����̶Ƚ��������ֵ��룬���ڵ���ƽ�⣬��NaHSO3��ˮ��Һ�еĵ��뷽��ʽΪNaHSO3=HSO3-��Na+��HSO3-![]() SO32-+H+��
SO32-+H+��
���ɱ������ݿ�֪������H 2SO3��HSO3-��H2CO3����H 2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪH2SO3��HCO3-=HSO3-��CO2����H2O��

����Ŀ��X��Y��Z��W�������ʵ�ת����ϵ��ͼ��ʾ(���ַ�Ӧ�����������),��������в����ϸù�ϵ����
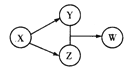
A | B | C | D | |
X | HCl | Na202 | Na2C03 | Al |
Y | FeCl2 | NaOH | CO2 | Na[Al(OH)4] |
Z | Cl2 | Na2C03 | CaC03 | AlCl3 |
W | FeCl3 | NaHCO3 | Ca(HCO3)2 | Al(OH)3 |
A. A B. B C. C D. D
����Ŀ��ǰ������Ԫ��A��B��C��D��E��ԭ��������������̬Aԭ�Ӻ������ռ��3���������̬Bԭ�Ӻ������ռ��3���ܼ���ÿ���ܼ��ϵ�������ȣ�C��˫ԭ�ӵ��ʷ�����������������Ŀ֮��Ϊ1:2��D����������ϼۺ�������ϼ�֮�͵���4����̬Eԭ�Ӻ�����6��δ�ɶԵ��ӡ�
��1����̬Eԭ�ӵĺ�������Ų�ʽΪ______����̬Dԭ�Ӻ������ռ�ݵ�������ߵ��ܼ�����Ϊ_____________��
��2��AԪ�صĸ������������£�
�ܼ�(I) | I1 | I2 | I3 | I4 | I5 |
������/kJ��mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
�����ϱ�����֪�������������ӵĵ������У�I3��I4֮������������Ҫԭ����__________��
��3��A��B��CԪ�ص�����������Ӧ��ˮ��������������ǿ����ԭ����________��
��4����Ԫ����A��B��CԪ����ɵĹ��۷���ACl3��BCl4��CCl3�У�����ԭ�Ӳ���sp3�ӻ������幹��Ϊ�����ε���_______(�����ʽ)��
��5��(DC)4Ϊ��ɫ�Թ��壬����ɫ��ЧӦ������-30��ʱΪ����ɫ��������Ϊ�Ȼ�ɫ������100��ʱΪ���ɫ���ڵ���ɫ���Ȼ�ɫ�����ɫ��ת���У��ƻ�����������____���ڳ�ѹ�£�(DC)4����130���ֽ�Ϊ��Ӧ�ĵ��ʣ���һ�仯���ƻ�����������_______����B��C��D�ļ���̬�⻯���У����ڷǼ��Է��ӵ���______(�����ʽ����ͬ)������Cu2+��Zn2+��Ag+���γ������ӵ���_______________��
��6��A��C�γ��������壬����ṹ���ƽ��ʯ����ͼ��ʾ����֪���þ����ܶ�Ϊ��g���M-3��NA��������٤��������ֵ��

�ٸþ���Ļ�ѧʽΪ__________��
���ڸþ����У�A��C�γɹ��ۼ��ļ���(d)Ϊ_____pm��