题目内容
【题目】(1)工业上用_______和_______为原料制取漂白粉,有效成份是_______,制备原理是______________________(方程式表示)。漂白粉用于漂白的时候,最好与稀盐酸反应,有关化学方程式为______________________________________。
(2)Ca元素在周期表中的位置是__,Ca与最活泼的非金属元素A形成化合物D,D的电子式为___,HCl的沸点比A与H形成的化合物HA的沸点__(填“高”或“低”)。
【答案】Cl2消石灰Ca(ClO)22Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O2HCl+Ca(ClO)2=CaCl2+2HClO第四周期第ⅡA族![]() 低
低
【解析】
(1)工业上用氯气和消石灰原料制取漂白粉,漂白粉是氯化钙和次氯酸钙的混合物,其有效成份是Ca(ClO)2,制备漂白粉的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。盐酸的酸性强于次氯酸,漂白粉用于漂白的时候,最好与稀盐酸反应,有关化学方程式为2HCl+Ca(ClO)2=CaCl2+2HClO。
(2)Ca元素的原子序数是20,在周期表中的位置是第四周期第ⅡA族,Ca与最活泼的非金属元素F形成化合物D是CaF2,CaF2是离子化合物,电子式为![]() 。由于HF分子间能形成氢键,所以HCl的沸点比HF的沸点低。
。由于HF分子间能形成氢键,所以HCl的沸点比HF的沸点低。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。已知:298K时,四种物质的电离平衡常数(K)如下表。
HNO2 | NH3·H2O | H2CO3 | H2SO3 | |
K(mol·L-1)-2 | 5.1×10-4 | 1.8×10-5 | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10﹣2 Ka2=6.3×10﹣8 |
(1)下列不能说明HNO2是弱电解质的是_____。
a.常温下0.1 mol·L-1 NaNO2溶液的pH>7
b.用一定浓度HNO2溶液做导电实验,灯泡很暗
c.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
d.常温下,0.1mol·L-1 HNO2溶液的pH=2.3
(2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为_____(填“酸性”、“碱性”或“中性”);298K时,将10mL pH=3的亚硝酸溶液与10mL pH=11氨水混合,所得溶液为_____(填“酸性”、“碱性”或“中性”)。
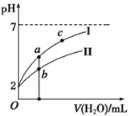
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如右图所示,判断曲线I对应的溶液为_______(填化学式)。图中a、b、c三点对应溶液的导电能力由强到弱的顺序是_______(用a、b、c表示,下同);溶液中水的电离程度由强到弱的顺序是__________。
(4)依据提供数据回答下列问题。
①NaH SO3在水溶液中的电离方程式为___________________。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________。