题目内容
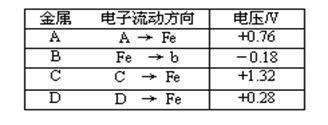
(16分)如下图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液。
(1)A、B、C三个装置中属于电解池的是_____________。
(2)A池中Cu是 ___ 极,A池中总反应的离子方程式为_________________ ___。
(3) B池中C电极上发生__ ______ _反应(填“氧化”或“还原”),
B池中总反应的化学方程式为_ 。
(4 C池中Cu是__________极,电极反应为 。
反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。

(1)A、B、C三个装置中属于电解池的是_____________。
(2)A池中Cu是 ___ 极,A池中总反应的离子方程式为_________________ ___。
(3) B池中C电极上发生__ ______ _反应(填“氧化”或“还原”),
B池中总反应的化学方程式为_ 。
(4 C池中Cu是__________极,电极反应为 。
反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。
(16分,每空各2分)(1)BC(2)正,Zn+Cu2+====Zn2++Cu
(3)还原 CuCl2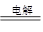 Cu+Cl2↑ (4) 阳 Cu-2e-====Cu2+ 不变
Cu+Cl2↑ (4) 阳 Cu-2e-====Cu2+ 不变
(3)还原 CuCl2
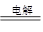 Cu+Cl2↑ (4) 阳 Cu-2e-====Cu2+ 不变
Cu+Cl2↑ (4) 阳 Cu-2e-====Cu2+ 不变(1)有外接电源的是电解池,所以BC是电解池,A是原电池。
(2)锌比铜活泼,所以锌是负极,失去电子。铜是正极,溶液中的铜离子得到电子,总反应式是Zn+Cu2+====Zn2++Cu。
(3)碳棒和电源的负极相连,作阴极,溶液中的铜离子得到电子,发生还原反应。阳极是氯离子失去电子,所以总反应式是CuCl2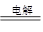 Cu+Cl2↑。
Cu+Cl2↑。
(4)铜和电源的正极相连,作阳极,失去电子,反应式是Cu-2e-====Cu2+;锌是阴极,溶液中的铜离子在阴极得到电子而析出铜,所以溶液中铜离子浓度不变。
(2)锌比铜活泼,所以锌是负极,失去电子。铜是正极,溶液中的铜离子得到电子,总反应式是Zn+Cu2+====Zn2++Cu。
(3)碳棒和电源的负极相连,作阴极,溶液中的铜离子得到电子,发生还原反应。阳极是氯离子失去电子,所以总反应式是CuCl2
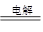 Cu+Cl2↑。
Cu+Cl2↑。(4)铜和电源的正极相连,作阳极,失去电子,反应式是Cu-2e-====Cu2+;锌是阴极,溶液中的铜离子在阴极得到电子而析出铜,所以溶液中铜离子浓度不变。

练习册系列答案
相关题目
 2PbSO4+2H2O。下列关于铅蓄电池的说法不正确的是( )
2PbSO4+2H2O。下列关于铅蓄电池的说法不正确的是( ) 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是 (填序号)
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是 (填序号)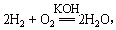 则负极反应式为___ _____________ _,正极反应式为 。一段时间后,KOH溶液的浓度 (填“变大”、“变小”或“不变”)
则负极反应式为___ _____________ _,正极反应式为 。一段时间后,KOH溶液的浓度 (填“变大”、“变小”或“不变”)