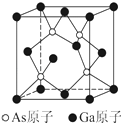
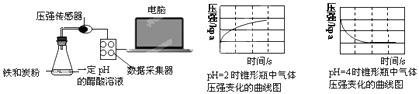
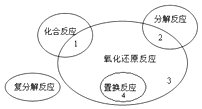
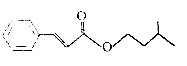
题目内容
【题目】用 0.2 mol·L -1某金属阳离子 Rn+的盐溶液 40mL,恰好将 20 mL 0.4 mol·L -1的硫酸盐中的硫酸根离子完全沉淀,则 n 值为( )
A. 1 B. 2 C. 3 D. 4
【答案】B
【解析】溶液中SO42-离子的物质的量为:20mL×10-3×0.4molL-1=8×10-3 mol,溶液中Rn+离子的物质的量为:40mL×10-3×0.2molL-1=8×10-3mol,由反应中恰好将溶液中的Mn+离子完全沉淀为硫酸盐时M的化合价为+n,则SO42-与Rn+反应对应的关系式为:
2Rn+~n SO42-
2 n
8×10-3mol 8×10-3mol
解得n=2,故选答案B。

练习册系列答案
相关题目