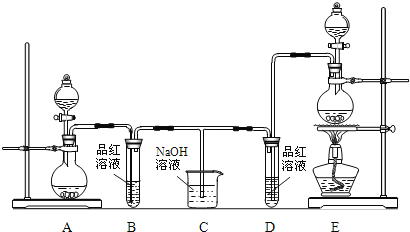
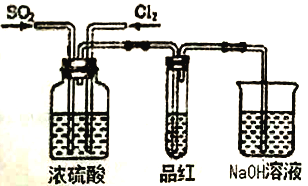
��Ŀ����
����Ŀ������Ԫ�غ�����Ԫ���������������к���Ҫ�ĵ�λ��
��1��д������Ԫ��Ga�Ļ�̬ԭ�Ӻ�������Ų�ʽ
��2��NF3�ķ��ӹ���Ϊ �� NO3���Ŀռ乹��Ϊ �� 1mol NO3���к��еĦҼ�����ĿΪ�� ��
��3��������������ᾧ�ı��屻��Ϊ����֪����Ӳ�����ʣ�BN�ľ���ṹ����ʯ���ƣ�����Bԭ�ӵ��ӻ���ʽΪ
��4��Ԫ�ص�һ�����ܵĴ�С��As���������������=����Ga��ԭ���� ��
��5����ͬ�����£���ˮ�е��ܽ�ȣ�NH3���������������=����PH3 �� ԭ���� ��
��6����֪�����黯�ؾ����Ľṹ��ͼ��ʾ���侧���߳�Ϊc pm�����黯�صĻ�ѧʽΪ �� ������Asԭ�Ӻ��������Gaԭ��֮��ľ���Ϊpm���ú�c��ʽ�ӱ�ʾ�����黯�ص��ܶ�Ϊgcm��3����NAΪ����٤��������ֵ���ú�c��NA��ʽ�ӱ�ʾ��ԭ������Ga��70��As��75���� 
���𰸡�
��1��1s22s22p63s23p63d104s24p1
��2�������Σ�ƽ�������Σ�3NA
��3��sp3
��4������As��Gaλ��ͬһ���ڣ��ֱ�Ϊ��A���A�壬As��p������ڰ�������ȶ�״̬���ʵ�һ�����ܣ�As��Ga
��5������NH3������ˮ����֮���ܹ��γ����
��6��GaAs��![]() ��
��![]()
���������⣺��1��GaԪ��ԭ�Ӻ��������Ϊ31����������Ų�ʽΪ��1s22s22p63s23p63d104s24p1 �� ���Դ��ǣ�1s22s22p63s23p63d104s24p1����2��NF3��Nԭ�ӹµ��Ӷ���= ![]() =1���۲���Ӷ���=3+1=4��Ϊ�����Σ�NO3����Nԭ�ӹµ��Ӷ���=
=1���۲���Ӷ���=3+1=4��Ϊ�����Σ�NO3����Nԭ�ӹµ��Ӷ���= ![]() =0���۲���Ӷ���=3+0=3��Ϊƽ�������Σ�1mol NO3���к���3mol �Ҽ���������3NA���Ҽ���
=0���۲���Ӷ���=3+0=3��Ϊƽ�������Σ�1mol NO3���к���3mol �Ҽ���������3NA���Ҽ���
���Դ��ǣ������Σ�ƽ�������Σ�3NA����3��BN�ľ���ṹ����ʯ���ƣ�Bԭ����Nԭ��֮���γ�4��B��N������1��Ϊ��λ�������ӻ������ĿΪ4����Bԭ�Ӳ�ȡ�ӻ���
���Դ��ǣ�sp3����4��As��Gaλ��ͬһ���ڣ��ֱ�Ϊ��A���A�壬As��p������ڰ�������ȶ�״̬���ʵ�һ�����ܣ�As��Ga��
���Դ��ǣ�����As��Gaλ��ͬһ���ڣ��ֱ�Ϊ��A���A�壬As��p������ڰ�������ȶ�״̬���ʵ�һ�����ܣ�As��Ga����5��NH3������ˮ����֮���ܹ��γ��������ˮ�е��ܽ�ȣ�NH3��PH3 ��
���Դ��ǣ�����NH3������ˮ����֮���ܹ��γ��������6�������к���Gaԭ����Ϊ8�� ![]() +6��
+6�� ![]() =4��Asԭ����ĿΪ4���ʻ�ѧʽΪGaAs��
=4��Asԭ����ĿΪ4���ʻ�ѧʽΪGaAs��
Asԭ������Χ��4��Gaԭ���γ��������壬Asԭ���뾧������Gaԭ�����ߴ��ھ�����Խ����ϣ���Gaԭ����Asԭ��֮��ľ���Ϊ������Խ��߳��ȵ� ![]() �������Ծ�������Խ���Ϊ�����ⳤ��
�������Ծ�������Խ���Ϊ�����ⳤ�� ![]() ������Gaԭ����Asԭ��֮��ľ���Ϊ
������Gaԭ����Asԭ��֮��ľ���Ϊ ![]() pm��
pm��
��������Ϊ4�� ![]() g�����ܶ�Ϊ4��
g�����ܶ�Ϊ4�� ![]() g�£�c��10��10 cm��3=
g�£�c��10��10 cm��3= ![]() gcm��3 ��
gcm��3 ��
���Դ��ǣ�GaAs�� ![]() ��
�� ![]() ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�