题目内容
【题目】一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。请回答下列问题:
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是________________。
A .Fe B.Fe2+ C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+,在此过程中__________是氧化剂,说明维生素C具有____性。
(3)己知下列反应: ①2I-+2Fe3+=2Fe2+ +I2 ②2Fe2++H2O2+2H+=2Fe3++2H2O, 则Fe3+ 、I2 、H2O2三者的氧化性由强到弱为____________________________。
(4)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中, HNO3表现的性质为_______ ,毎有1 molFe参加反应转移电子_____________mol。
(5)用双线桥标出该反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O电子转移的数目和方向______________
【答案】 B Fe3+ 还原性 H2O2>Fe3+>I2 氧化性 酸性 3 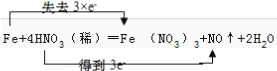
【解析】(1)A .Fe单质中铁的化合价为0,为最低价,只具有还原性,选项A不选;B.Fe2+ 化合价为+2价,处于中间价态,既有氧化性又有还原性,选项B选;C. Fe3+ 为铁的高价态,通常只具有氧化性,选项C不选;答案选B;(2)维生素C可使食物中的Fe3+转化为Fe2+,铁元素的化合价升高,在此过程中Fe3+是氧化剂,将维生素C氧化,说明维生素C具有还原性;(3)反应①2I-+2Fe3+=2Fe2+ +I2 中铁元素化合价由+3价降为+2价,Fe3+为氧化剂,I2为氧化产物,氧化性:Fe3+>I2;②2Fe2++H2O2+2H+=2Fe3++2H2O中氧元素化合价由-1价降为-2价,H2O2为氧化剂,Fe3+为氧化产物,氧化性:H2O2> Fe3+; 则Fe3+ 、I2 、H2O2三者的氧化性由强到弱为:H2O2>Fe3+>I2;(4)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中氮元素化合价由+5价降为+2价,被还原,HNO3表现的性质为氧化性,铁元素化合价由0价升高为+3价,被氧化,毎有1 molFe参加反应转移电子3mol;(5)Fe元素的化合价由0升高为+3价,硝酸中N元素的化合价由+5价降低为+2价,该反应中1molFe反应转移3mol电子,则电子转移方向和数目为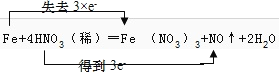 。
。