题目内容
7.化学与环境保护密切相关,下列叙述正确的是( )| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 处理废水时加入明矾作为消毒剂对水进行杀菌消毒 | |
| C. | PM2.5(2.5微米以下的细颗粒物)主要来自化石燃料的燃烧 | |
| D. | 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
分析 A.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染;
B.明矾不具有氧化性,不能做消毒剂;
C.化石燃料燃烧排放出大量的固体颗粒物,导致粉尘污染;
D.正常的雨水溶解二氧化碳,其pH为5.6,pH值小于5.6为酸雨,pH由4.68变为4.28,主要是雨水中溶解的二氧化硫生成亚硫酸,亚硫酸被氧化为硫酸.
解答 解:A.从源头上减少和消除工业生产对环境的污染是绿色化学的核心,故A错误;
B.明矾用作废水处理的混凝剂,明矾溶于水可以形成Al(OH)3胶体,胶体具有很大的表面积,吸附悬浮物质而沉降,起净水作用,是常用的净水剂,但是明矾没有氧化性不能作为消毒剂,故B错误;
C.化石燃料包括煤、石油、天然气,煤炭发电能产生很多颗粒,有的颗粒能达到直径≤2.5微米,汽车尾气中也能释放出直径≤2.5微米的颗粒物,2.5微米以下的细颗粒物主要来自化石燃料的燃烧,故C正确;
D.正常的雨水溶解二氧化碳,其PH为5.6,pH值小于5.6为酸雨,pH由4.68变为4.28,主要是雨水中溶解的二氧化硫生成亚硫酸,亚硫酸被氧化为硫酸,由弱酸转化为强酸,酸性增强,故D错误;
故选:C.
点评 本题考查化学与生产、生活相关的知识,是高考的频考点,明确绿色化学的含义及常见环境污染的原因与治理是解题关键,题目难度不大,注意对相关知识的积累.

练习册系列答案
相关题目
6.为除去括号内的杂质,下列各选项中所选用的试剂或方法不正确的是( )
| A. | NaHCO3溶液(Na2CO3),应通入过量的CO2气体 | |
| B. | NaBr溶液(NaI),应加入适量的氯水、CCl4,进行萃取分液 | |
| C. | NH4Cl溶液(FeCl3),应加入适量的氨水,过滤 | |
| D. | CO2(CO),通过过量的灼热的氧化铜粉末 |
7.化学与社会、生活密切相关,下列现象或事实与对应的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 蔗糖、淀粉、纤维素等有甜味 | 人体内,糖类在淀粉酶的作用下能发生水解,生成葡萄糖 |
| B | 煤通过气化和液化等化学变化可以有效地控制酸雨 | 煤通过气化和液化处理,其产品中硫的含量将大大降低 |
| C | 地沟油经过处理加工后可用作飞机、汽车燃油 | 地沟油的成分是液态烃 |
| D | 在钢铁制品的表面镀上一层锡,可有效防止其被腐蚀 | 形成原电池时锡是负极被氧化,而钢铁制品作为正极被保护 |
| A. | A | B. | B | C. | C | D. | D |
15.某学习小组对Cl2与FeCl2和KSCN混合溶液的反应进行探究.
(1)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(2)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(3)为探究现象2产生的原因,该小组进行如下实验:
①取A中黄色溶液少许于试管中,加入NaOH溶液,有红褐色沉淀生成,则原溶液中一定存在Fe3+.
②取A中黄色溶液少许于试管中,加入过量的KSCN溶液,最终得到红色溶液.该小组同学此得出结论:产生现象2的原因是SCN-与Cl2发生了反应.
(4)该小组同学猜想SCN-可能被Cl2氧化了,于是又进行了如下探究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是S元素.
②在实验中SCN-中氮元素被氧化为NO3-,检验NO3-存在的方法是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,则证明SCN-中氮元素被氧化为NO3-.
③已知SCN-中各原子均满足8电子稳定结构,试写出SCN-的电子式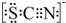 .
.
(5)若SCN-与Cl2反应生成1molCO2,则转移的电子数是16mol.
| 操作 | 现象 |
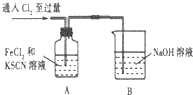 | 1.A中溶液变红 2.稍后,A中溶液由红色变为黄色 |
(2)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(3)为探究现象2产生的原因,该小组进行如下实验:
①取A中黄色溶液少许于试管中,加入NaOH溶液,有红褐色沉淀生成,则原溶液中一定存在Fe3+.
②取A中黄色溶液少许于试管中,加入过量的KSCN溶液,最终得到红色溶液.该小组同学此得出结论:产生现象2的原因是SCN-与Cl2发生了反应.
(4)该小组同学猜想SCN-可能被Cl2氧化了,于是又进行了如下探究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是S元素.
②在实验中SCN-中氮元素被氧化为NO3-,检验NO3-存在的方法是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,则证明SCN-中氮元素被氧化为NO3-.
③已知SCN-中各原子均满足8电子稳定结构,试写出SCN-的电子式
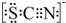 .
.(5)若SCN-与Cl2反应生成1molCO2,则转移的电子数是16mol.
12.通常用来衡量一个国家石油化工发展水平的标志是( )
| A. | 石油的产量 | B. | 乙烯的产量 | C. | 硫酸的产量 | D. | 合成纤维的产量 |
16.某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度.有关的叙述正确的是( )
| A. | H2Y的电离方程式为:H2Y+2H2O?2H3O++Y2- | |
| B. | 在该酸式盐溶液中c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解方程式为HY-+H2O?H3O++Y2- | |
| D. | 在该酸式盐溶液中c(Na+)>c(HY-)>c(OH-)>c(H+) |
17.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: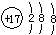 | |
| B. | 作为相对原子质量测定标准的碳核素:12C | |
| C. | 氨气(NH3)中氮元素的化合价是+3 | |
| D. | Na+的电子式:Na+ |
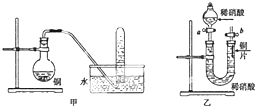 如图是甲、乙两位同学探究铜与稀硝酸.反应还原产物的实验装置图,请回答下列问题:
如图是甲、乙两位同学探究铜与稀硝酸.反应还原产物的实验装置图,请回答下列问题: