题目内容
21世纪是钛的世纪.在800℃~1000℃时电解TiO2可制得钛,装置如图所示.下列叙述正确的是( )


| A、a为电源的正极 |
| B、石墨电极上发生还原反应 |
| C、阴极发生的反应为:TiO2+4e-═Ti+2O2- |
| D、每生成0.1mol钛,转移电子0.2mol |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:图为电解装置,由阴离子的定向移动可知石墨为阳极,则a为负极,b为正极,TiO2为阴极,电解时,阴极发生还原反应,阳极发生氧化反应,以此解答该题.
解答:
解:由阴离子的定向移动可知石墨为阳极,则a为负极,b为正极,TiO2为阴极,
A.a为电源的负极,故A错误;
B.石墨为阳极,电极上发生氧化反应,故B错误;
C.电解TiO2制得钛,TiO2为阴极,发生还原反应,电极方程式为TiO2+4e-═Ti+2O2-,故C正确;
D.Ti元素化合价由+4价降低到0价,则每生成0.1mol钛,转移电子0.4mol,故D错误.
故选C.
A.a为电源的负极,故A错误;
B.石墨为阳极,电极上发生氧化反应,故B错误;
C.电解TiO2制得钛,TiO2为阴极,发生还原反应,电极方程式为TiO2+4e-═Ti+2O2-,故C正确;
D.Ti元素化合价由+4价降低到0价,则每生成0.1mol钛,转移电子0.4mol,故D错误.
故选C.
点评:本题考查电解知识,为高频考点,侧重于学生的分析能力的考查,注意把握电解原理以及电极方程式的书写,根据离子的定向移动判断电极为解答该题的关键,难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
下列反应的离子方程式书写正确的是( )
A、用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-
| ||
| B、用二氧化硫水溶液吸收溴蒸气:SO2+Br2+2H2O=2H++SO42-+2HBr | ||
| C、在(NH4)2SO4溶液中逐滴加入少量的Ba(OH)2溶液:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3?H2O | ||
| D、次氯酸钙溶液中通入少量SO2气体:Ba2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
NA为阿伏加德罗常数,下列叙述错误的是( )
| A、0.1mol Na2O2与足量水完全反应时,转移电子数目为0.1NA |
| B、12g金刚石含有的共价键数为2NA |
| C、0.1mol的铜与足量的浓硫酸反应生成SO2的体积(标况)约为2.24L |
| D、在1L 0.1mol?L-1碳酸钠溶液中阴离子总数小于0.1NA |
下列实验操作或现象分析正确的是( )
A、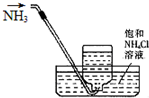 收集氨气 |
B、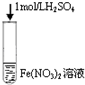 管口出现还原产物NO2红棕色气体 |
C、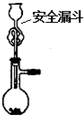 制取二氧化硫 |
D、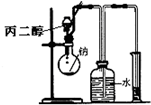 测定丙二醇的分子结构 |
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol/L Na2CO3溶液中:c(Na+)+c(H+)═c(CO32-)+c(HCO3-)+c(OH-) |
| B、向CH3COONa溶液中加入适量的CH3COOH,得到pH=4的混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、在等物质的量浓度的四种溶液①NH4Cl②CH3COONH4③NH4HSO4④NH3?H2O中,NH4+浓度大小顺序正确的是③>①>②>④ |
| D、0.1mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+) |
下列实验不能达到实验目的是( )
①实验窒用无水乙醇和浓硫酸共热到140℃即可制取乙烯
②验证R-X是碘代烷,把R-X与NaOH水溶液混合加热,再往其中加入硝酸银溶液即可
③做醛的还原性实验,向乙醛溶液中加入新制的Cu(OH)2悬浊液即可得到红色沉淀
④检验淀粉已水解,将淀粉与水和稀硫酸加热一段时间后,加入银氨溶液即可
⑤实验室制备乙酸乙酯,把乙醇和乙酸及稀硫酸溶液共热即可.
①实验窒用无水乙醇和浓硫酸共热到140℃即可制取乙烯
②验证R-X是碘代烷,把R-X与NaOH水溶液混合加热,再往其中加入硝酸银溶液即可
③做醛的还原性实验,向乙醛溶液中加入新制的Cu(OH)2悬浊液即可得到红色沉淀
④检验淀粉已水解,将淀粉与水和稀硫酸加热一段时间后,加入银氨溶液即可
⑤实验室制备乙酸乙酯,把乙醇和乙酸及稀硫酸溶液共热即可.
| A、①②③④⑤ | B、①③④ |
| C、①②③⑤ | D、②③⑤ |
某研究性学习小组对手性分子提出了以下四个观点:
①互为手性异构体的分子互为镜像
②利用手性催化剂合成可得到一种或主要得到一种手性分子
③手性异构体分子组成相同
④手性异构体性质相同
你认为正确的是( )
①互为手性异构体的分子互为镜像
②利用手性催化剂合成可得到一种或主要得到一种手性分子
③手性异构体分子组成相同
④手性异构体性质相同
你认为正确的是( )
| A、①②③ | B、①②④ |
| C、②③④ | D、全部 |
11.2g铁溶解在一定量的某浓度的稀硝酸中,当金属完全反应后生成Fe3+和Fe2+,并收集到标况下3.36L NO气体(设HNO3的还原产物只有NO).则反应中消耗的HNO3的物质的量为( )
| A、0.3mol |
| B、0.45mol |
| C、0.6mol |
| D、0.75mol |
20℃时,饱和KCl溶液的密度为1.174g/cm3,物质的量浓度为4.0mol/L,则下列说法中不正确的是( )
| A、25℃时,饱和KCl溶液的浓度大于4.0mol/L | ||
B、此溶液中KCl的质量分数为74.5×
| ||
| C、20℃时,密度小于1.174g/cm3的KCl溶液是不饱和溶液 | ||
| D、将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g/cm3 |