题目内容
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol/L Na2CO3溶液中:c(Na+)+c(H+)═c(CO32-)+c(HCO3-)+c(OH-) |
| B、向CH3COONa溶液中加入适量的CH3COOH,得到pH=4的混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、在等物质的量浓度的四种溶液①NH4Cl②CH3COONH4③NH4HSO4④NH3?H2O中,NH4+浓度大小顺序正确的是③>①>②>④ |
| D、0.1mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+) |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:A、电荷守恒,得:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-);
B、向CH3COONa溶液中加入适量的CH3COOH,溶液呈酸性,说明以醋酸的电离为主,所以离子溶液大小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
C、氢离子抑制铵根离子水解,醋酸根离子促进铵根离子水解;
D.电荷守恒为c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),物料守恒式为c(HCO3-)+c(H2CO3)+c(CO32-)=
c(Na+).
B、向CH3COONa溶液中加入适量的CH3COOH,溶液呈酸性,说明以醋酸的电离为主,所以离子溶液大小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
C、氢离子抑制铵根离子水解,醋酸根离子促进铵根离子水解;
D.电荷守恒为c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),物料守恒式为c(HCO3-)+c(H2CO3)+c(CO32-)=
| 1 |
| 3 |
解答:
解;A、电荷守恒,得:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-),故A错误;
B、向CH3COONa溶液中加入适量的CH3COOH,溶液呈酸性,说明以醋酸的电离为主,所以离子溶液大小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C、①NH4Cl是强酸弱碱盐,铵根离子能水解但较弱; ②CH3COONH4中醋酸根离子促进铵根离子水解,③NH4HSO4中氢离子抑制铵根离子水解; ④NH3?H2O是弱电解质,电离程度较小; 所以铵根离子浓度大小顺序是:③①②④,故C正确;
D.电荷守恒为c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),物料守恒式为c(HCO3-)+c(H2CO3)+c(CO32-)=
c(Na+),则3c(H2CO3)+2c(H+)+c(HCO3-)═2c(OH-)+c(CO32-),故D正确;
故选CD.
B、向CH3COONa溶液中加入适量的CH3COOH,溶液呈酸性,说明以醋酸的电离为主,所以离子溶液大小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C、①NH4Cl是强酸弱碱盐,铵根离子能水解但较弱; ②CH3COONH4中醋酸根离子促进铵根离子水解,③NH4HSO4中氢离子抑制铵根离子水解; ④NH3?H2O是弱电解质,电离程度较小; 所以铵根离子浓度大小顺序是:③①②④,故C正确;
D.电荷守恒为c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),物料守恒式为c(HCO3-)+c(H2CO3)+c(CO32-)=
| 1 |
| 3 |
故选CD.
点评:本题考查离子浓度大小的比较,熟悉溶液中的电荷守恒及物料守恒是解答本题的关键,注意选项A为解答的难点,题目难度中等.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
下列事实不能用勒沙特列原理解释的是( )
| A、氨水应密闭保存,放置低温处 |
| B、在FeCl2溶液中加入铁粉防止氧化变质 |
| C、常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5 |
| D、.实验室可用排饱和食盐水的方法收集氯气 |
在15mL苯中溶解560mL乙炔,再加入75g苯乙烯,所得混和液中碳元素的质量分数为( )
| A、40% | B、66.7% |
| C、75% | D、92.3% |
化学与生产、生活、社会密切相关,下列说法正确的是( )
| A、煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法 |
| B、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
| C、利用风能发电、使用太阳能热水器、应用无氟制冷剂均有利于降低大气中的二氧化碳 |
| D、积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料 |
21世纪是钛的世纪.在800℃~1000℃时电解TiO2可制得钛,装置如图所示.下列叙述正确的是( )


| A、a为电源的正极 |
| B、石墨电极上发生还原反应 |
| C、阴极发生的反应为:TiO2+4e-═Ti+2O2- |
| D、每生成0.1mol钛,转移电子0.2mol |
下列表达方式错误的是( )
A、碳-12原子
| ||
B、氟化钠的电子式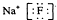 | ||
| C、硫离子的核外电子排布式 1s22s22p63s23p4 | ||
D、甲烷的电子式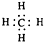 |
100mL浓度为2mol?L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A、加入适量的6mol?L-1的盐酸 |
| B、加入适量的氯化钠溶液或降温 |
| C、加入适量CH3COOK溶液 |
| D、加入2滴氯化铜溶液或碳粉 |
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A、质子数c>b |
| B、离子的还原性Y2->Z- |
| C、氢化物的稳定性H2Y>HZ |
| D、原子半径X<W |