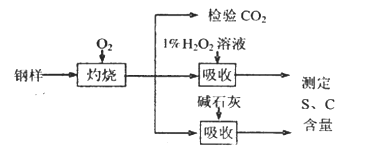
题目内容
【题目】已知A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
D元素简单离子半径是该周期中最小的 |
E元素是该周期电负性最大的元素 |
F所在族的元素种类是周期表中最多的 |
G在周期表的第十一列 |
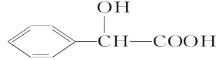
(1)已知BA5为离子化合物,写出其电子式__。
(2)B基态原子中能量最高的电子,其电子云在空间有__个方向,原子轨道呈__形。
(3)实验室制备E的单质的离子反应方程式为__。
(4)BE3在常温下是一种淡黄色的液体,其遇水即发生反应可生成一种具有漂白性的物质,写出反应的化学方程式__;该反应说明其中B和E中非金属性较强的是__填元素的符号。
(5)C与D的第一电离能大小为__。D与E的最高价氧化物对应水化物相互反应的离子方程式为__。
(6)G价电子排布图为__,位于__纵行。F元素的电子排布式为__,前四周期中未成对电子数最多的元素在周期表中位置为__(填周期和族)。
【答案】![]() 3 纺锤或哑铃 MnO2+4H++2Cl-
3 纺锤或哑铃 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O NCl3+3H2O=3HClO+NH3↑ N Mg>Al Al(OH)3+3H+=Al3++3H2O
Mn2++Cl2↑+2H2O NCl3+3H2O=3HClO+NH3↑ N Mg>Al Al(OH)3+3H+=Al3++3H2O 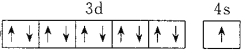 11 [Ar]3d14s2或1s22s22p63s23p63d14s2 第四周期第VIB族
11 [Ar]3d14s2或1s22s22p63s23p63d14s2 第四周期第VIB族
【解析】
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,则A为H;B元素原子的核外p电子数比s电子数少1,则排布式为1s22s22p3,为N;根据C原子的电离能,判断最外层有2个电子,则为Mg;D元素简单离子半径是该周期中最小的,则为Al;E元素是该周期电负性最大的元素Cl;G在周期表的第四周期第十一列,为Cu;元素种类最多的族为IB族, F为第四周期IB族,为Sc。
(1)A、B分别为H、N,则BA5为离子化合物,为氢化铵,电子式为![]() ;
;
(2)B为N,能量最高的电子为3p能级的电子,电子云在空间有3个方向,原子轨道呈纺锤形;
(3)E为Cl,实验室制备氯气时,用二氧化锰与浓盐酸共热制取,离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)B、E分别为N、Cl,NCl3在常温下是一种淡黄色的液体,其遇水即发生反应可生成一种具有漂白性的HClO和氨气,方程式为NCl3+3H2O=3HClO+NH3↑;反应中N的化合价由+3变为-3,有较强的非金属性;
(5)C、D分别为Mg、Al,镁最外层电子为3s2,为全充满的稳定结构,则第一电离能大于Al;高氯酸为强酸,氢氧化铝与高氯酸反应的离子方程式为Al(OH)3+3H+=Al3++3H2O;
(6)G为Cu,价电子排布图为![]() ;位于11纵行;F为Sc,电子排布式为[Ar]3d14s2或1s22s22p63s23p63d14s2;前四周期中未成对电子数最多的元素的价电子排布式为3d54s1为Cr,位置为第四周期VIB族。
;位于11纵行;F为Sc,电子排布式为[Ar]3d14s2或1s22s22p63s23p63d14s2;前四周期中未成对电子数最多的元素的价电子排布式为3d54s1为Cr,位置为第四周期VIB族。

【题目】用图所示装置检验乙烯时不需要除杂的是
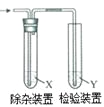
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |