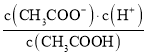��Ŀ����
����Ŀ��������������������ͷ�չ����Ҫ���ʻ������ش��������⣺
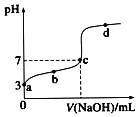
(1)�������������ܻ�ȡ�������ǽ������ϵ��� ______ (�����)��
�ٲ��ü���Ϊԭ�ϣ������������������������ʯ
�ڲ��ô�ͳ�����ý�̿��ԭSiO2�Ʊ�������
����ˮ�����������м����¯��������������;��ˮ��
���ڲ������������м���K��Pb��������������;�Ĺ�ѧ����
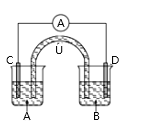
(2)ij������¯��һ��Ͷ�������ұ�����������ù�����ת�Ƶĵ���Ϊ1.60��105mol�������������ķ�Ӧ��Ҳ�����������е����ʣ������õ�����Ϊ ______t�������к�̼�����Ԫ�ؽ϶࣬������������Ϊԭ�ϣ���ȥ�����̼���������Ԫ�أ����г�ȥ��Ļ�ѧ����ʽΪ ______��
(3)��ҵ������Al�Ĺ����������£�

�ù����б���ʯ�ͷ����Ƶ������� ______������W�Ļ�ѧʽΪ ______ ����������Ĵ���Ϊ60%����ȡW����ʧ��Ϊ3%�����ʱ��ʧ��Ϊ0.1%����������ʱ����ʧ��Ϊ2%�����������ĺ���Ϊ99.9%����ô1.0t��������Ʊ����� ______t��
(4)������ʴ��������ʧ��������������ʴ��Ϊ������ʴ����������ӦʽΪ ______������������ʩ�ܶ࣬������������(����Zn)������������������������ӦʽΪ ______��
���𰸡��٢� 3.36 FeS+CaO![]() FeO+CaS ����Al2O3���۵㣬�������ڵ���ʵ��ܺ� Al2O3 0.3 O2+2H2O+4e-=4OH- Zn-2e-=Zn2+
FeO+CaS ����Al2O3���۵㣬�������ڵ���ʵ��ܺ� Al2O3 0.3 O2+2H2O+4e-=4OH- Zn-2e-=Zn2+
��������
(1)��ͳ���ǽ��������ǹ�ҵ�ͻ�������������Ļ������ϣ��粣����ˮ��ȣ��������ǽ���������20���������Ժ�չ�����ģ������������ܺ���;�IJ��ϣ��������ִ��¼������²�ҵ����ͳ��ҵ�������졢�ִ�����������ҽѧ������ȱ�ٵ����ʻ������ݴ˽����жϣ�
(2)���������Ҫ�ɷ�Ϊ���������������ݵ����غ��ȼ���������������ʵ������ټ��������������������������д���������������Ʒ�Ӧ�Ļ�ѧ����ʽ��
(3)����ʯ���ܽ�Al2O3���壬���������ۼ�����Al2O3���۵㣻WΪ���������Ҫ�ɷ����������������������������Ȼ��������Ԫ�������غ���ʽ���㣻
(4)��������(����Zn)����������������������пʧȥ��������п���ӣ��ݴ�д���缫��Ӧʽ��
(1)�ٲ��ü���Ϊԭ�ϣ����������������������Ľ��ʯΪ�������ǽ������ϣ�����ȷ��
�ڲ��ô�ͳ�����ý�̿��ԭSiO2�Ʊ��ĵ�����Ϊ�������ǽ������ϣ�����ȷ��
��ˮ���Ǵ�ͳ���ǽ������ϣ��۴���
�ܹ�ѧ�����Ǵ�ͳ���ǽ������ϣ��ܴ���
�ʺ���ѡ���Ǣ٢ڣ�
(2)������������ѧʽΪFe3O4��������Ԫ�ص�ƽ�����ϼ�Ϊ+![]() ���ù�����ת�Ƶĵ���Ϊ1.60��105mol��������Fe�����ʵ���n(Fe)=
���ù�����ת�Ƶĵ���Ϊ1.60��105mol��������Fe�����ʵ���n(Fe)= 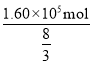 =6��104mol�����Եõ�����������Ϊ��m=56g/mol��6��104mol=3.36��106g=3.36t��ͨ����CaO��ȥ��Ӧ��ѧ����ʽΪ��FeS+CaO
=6��104mol�����Եõ�����������Ϊ��m=56g/mol��6��104mol=3.36��106g=3.36t��ͨ����CaO��ȥ��Ӧ��ѧ����ʽΪ��FeS+CaO![]() FeO+CaS��
FeO+CaS��
(3)Al2O3�������Ӿ��壬�۵�ϸߣ��������ʯ�ͷ����ƣ����ڵı���ʯ�ͷ��������ܽ�Al2O3���壬�������ڵ��ұ����ʱ���������ۼ������������������ۻ�ʱ������¶ȣ��ڽ�������ұ���м������ʯ�ͷ����Ƶ�Ŀ���ǽ���Al2O3���۵㣬�������ڵ���ʵ��ܺģ�W������������Ҫ�ɷ�����������ѧʽΪAl2O3��
�����ɵ�����������Ϊx��������Ԫ�������غ�ɵã�1.0t��60%��![]() ��(1-3%)��(1-0.1%)��(1-2%)=99.9%x����ã�x=0.3t��
��(1-3%)��(1-0.1%)��(1-2%)=99.9%x����ã�x=0.3t��
(4)��������ʴ�У������������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ��O2+2H2O+4e-=4OH-���ڽ���������ʩ�У���������(����Zn)������Ϊԭ��ص�������������ԭ��Ӧ����������(����Zn)Ϊ������Znʧȥ��������Zn2+���缫��ӦʽΪ��Zn-2e-=Zn2+��

����Ŀ��NaClO��Ư��Һ����Ч�ɷ֣�ij�о�С��̽��NaClO��Һ�����ʣ����������ʵ�飺
װ��ͼ | �Լ�X | ʵ������ | |
|
|
| ��������ɫ���� |
|
| ��Һ���� | |
|
| ��Һ��� | |
|
| ������ɫ���� | |
�����жϲ���ȷ����![]()
![]()
A.ʵ��![]() �з�������Ҫ��Ӧ��
�з�������Ҫ��Ӧ��![]()
B.ʵ��![]() �з�������Ҫ��Ӧ��
�з�������Ҫ��Ӧ��![]()
C.ʵ��![]() �и�������������ǿ��
�и�������������ǿ��![]()
D.ʵ��![]() ��
��![]() ��
��![]() ��ٽ�ˮ��
��ٽ�ˮ��
����Ŀ����֪A��B��C��D��EΪ����������Ԫ�أ�F��GΪ��������Ԫ�أ����ǵ�ԭ��������������
AԪ�صĺ���������͵��Ӳ�����ȣ�Ҳ����������ḻ��Ԫ�� |
BԪ��ԭ�ӵĺ���p��������s��������1 |
Cԭ�ӵĵ�һ�����ĵ����ֱܷ��ǣ�I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
DԪ�ؼ����Ӱ뾶�Ǹ���������С�� |
EԪ���Ǹ����ڵ縺������Ԫ�� |
F�������Ԫ�����������ڱ������� |
G�����ڱ��ĵ�ʮһ�� |
��1����֪BA5Ϊ���ӻ����д�������ʽ__��
��2��B��̬ԭ����������ߵĵ��ӣ���������ڿռ���__������ԭ�ӹ����__�Ρ�
��3��ʵ�����Ʊ�E�ĵ��ʵ����ӷ�Ӧ����ʽΪ__��
��4��BE3�ڳ�������һ�ֵ���ɫ��Һ�壬����ˮ��������Ӧ������һ�־���Ư���Ե����ʣ�д����Ӧ�Ļ�ѧ����ʽ__���÷�Ӧ˵������B��E�зǽ����Խ�ǿ����__��Ԫ�صķ�����
��5��C��D�ĵ�һ�����ܴ�СΪ__��D��E������������Ӧˮ�������Ӧ�����ӷ���ʽΪ__��
��6��G�۵����Ų�ͼΪ__��λ��__���С�FԪ�صĵ����Ų�ʽΪ__��ǰ��������δ�ɶԵ���������Ԫ�������ڱ���λ��Ϊ__�������ں��壩��