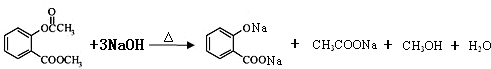
题目内容
10.短周期主族元素X、Y、Z、W、M的原子序数依次增大,其中Y和W的原子序数相差8,W原子最外层电子数是Z原子最外层电子数的2倍,Y、Z、W三种原子的最外层电子数之和为15,X的最高正价和最低负价的代数和为0.下列说法正确的是( )| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | 元素Z、M的简单离子的电子层结构相同 | |
| C. | W的简单气态氢化物的热稳定性比M的差 | |
| D. | 元素X和Y形成的化合物只有一种 |
分析 短周期主族元素X、Y、Z、W、M的原子序数依次增大.其中Y和W的原子序数相差8,Y不可能为H元素,故二者只能为同主族元素,则Y为O元素、W为S元素,结合原子序数可知M为Cl,W原子最外层电子数是Z原子最外层电子数的2倍,则Z原子最外层电子数为3,原子序数大于氧,故Z为Al,O、Al、S三种原子的最外层电子数之和为15,X的最高正价和最低负价的代数和为0,原子序数小于氧,故X为H元素或C元素,据此解答.
解答 解:短周期主族元素X、Y、Z、W、M的原子序数依次增大.其中Y和W的原子序数相差8,Y不可能为H元素,故二者只能为同主族元素,则Y为O元素、W为S元素,结合原子序数可知M为Cl,W原子最外层电子数是Z原子最外层电子数的2倍,则Z原子最外层电子数为3,原子序数大于氧,故Z为Al,O、Al、S三种原子的最外层电子数之和为15,X的最高正价和最低负价的代数和为0,原子序数小于氧,故X为H元素或C元素.
A.同周期自左而右原子半径减小,同主族自上而下原子半径越大,故原子半径:r(Al)>r(S)>r(O),故A错误;
B.Al3+离子核外电子数为10、Cl-离子核外电子数为18,二者核外电子层结构不相同,故B错误;
C.非金属性S<Cl,故氢化物稳定性H2S<HCl,故C正确;
D.元素X为H元素或碳元素,与氧元素分别可以形成H2O2、H2O及CO2、CO,故D错误,
故选C.
点评 本题考查位置结构性质关系应用,推断元素是解题关键,较好的考查分析推理能力,注意X元素的不确定性,注意H元素化合价.

练习册系列答案
相关题目
14.下列化学用语的表达正确的是( )
| A. | Na2SO4电离:Na2SO4=Na2++SO42- | |
| B. | 氯化钠的分子式:NaCl | |
| C. | 质子数为6,中子数为8的微粒:${\;}_{6}^{8}$C | |
| D. | 医用“钡餐”的化学式:BaSO4 |
1.下列实验操作、现象和解释都正确的是( )
| 选项 | 实验操作 | 现象 | 解释 |
| A | 向某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32- |
| B | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 上层呈紫红色,下层有白色沉淀生产 | 铜离子可以氧化碘离子,白色沉淀可能为CuI |
| D | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
18.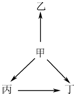 下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )
 下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | N2 | NH3 | NO | NO2 |
| B | Na | Na2O | NaOH | Na2O2 |
| C | SiO2 | SiF4 | H2SiO3 | Na2SiO3 |
| D | Al | AlCl3 | Al2O3 | NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
15. 室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )
室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )
 室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )
室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )| A. | Ⅱ表示的是滴定氨水的曲线,当V(HCI)=20 mL时,有:c(Cl-)>c(N${{H}_{4}}^{+}$)>c(H+)>c(OH-) | |
| B. | 当pH=7时,滴定氨水消耗的V(HCl)=20 mL,且c(N${{H}_{4}}^{+}$)=c(Cl-) | |
| C. | 滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 当滴定氨水消耗V(HCl)=10 mL时,有:2[c(OH-)-c(H+)]=c(N${{H}_{4}}^{+}$)-c(NH3•H2O) |
2.W、X、Y、Z是四种短周期元素,其原子序数依次增大.已知甲是由其中三种元素组成的化合物,25℃时0.1mo1.L-1甲溶液的pH为13.X元素的气态氢化物可与其最高价氧化物对应的水化物反应生成盐.下列说法中,正确的是( )
| A. | 原子半径大小的比较:r(X)>r(Y)>r(Z) | |
| B. | 元素Y、Z的简单离子的电子层结构不同 | |
| C. | 元素X的简单气态氢化物的热稳定性比元素Y的强 | |
| D. | 只含W、X、Y三种元素的化合物中,有离子化合物,也有共价化合物 |
20.25℃的四种溶液:①pH=2的CH3COOH溶液 ②pH=2的HCl溶液 ③pH=12的氨水 ④pH=12的NaOH溶液.有关上述溶液的比较中,正确的是( )
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| D. | 向溶液中加入100 mL水后,溶液的pH:③>④>①>② |
 .
.