题目内容
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)已知:
H2(g)+I2(g)=2HI(g) ΔH=QkJ·mol-1
H2(g)+I2(s)=2HI(g) ΔH=+26.48kJ·mol-1
I2(g)=I2(s) ΔH=-37.48kJ·mol-1
化学键 | I—I | H—I |
键能/(kJ·mol-1) | 151 | 299 |
键能是将1mol气体分子AB断裂为中性气态原子A和B所需要的能量,单位为kJ·mol-1。
①Q=____kJ·mol-1。
②H—H键能为____kJ·mol-1。
(2)716K时,在恒容密闭容器中按物质的量之比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如图:
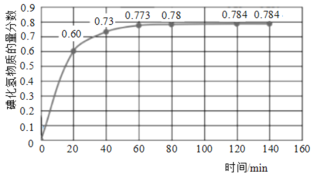
①若反应开始时气体混合物的总压为pkPa,则反应在前20min内的I2(g)平均速率![]() (I2)=___kPa·min-1(用含p的式子表示)。
(I2)=___kPa·min-1(用含p的式子表示)。
②在H2(g)+I2(g)![]() 2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,
2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,![]() =___(列出计算式)。
=___(列出计算式)。
③H2(g)+I2(g)![]() 2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是___。
2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是___。
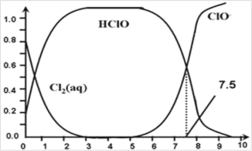
(3)一定条件下,NaClO可将溶液中的I-氧化为I2。通过测定体系的吸光度,检测到不同pH下I2的生成量随时间的变化关系如图。
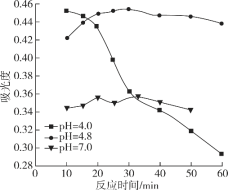
已知:吸光度越高表明该体系中c(I2)越大。
①pH=4.8时,在___min附近c(I2)最大。
②10min时,不同pH与吸光度的关系是___。
③pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因是___。
【答案】-11 436 0.015p ![]() 或
或![]() 降温使碘蒸气变为固态碘,导致反应物浓度降低,平衡逆向移动 30 pH越低,吸光度越高或pH越高,吸光度越低 c(H+)增大,ClO-氧化性增强,会继续将I2进一步氧化,c(I2)降低,吸光度下降
降温使碘蒸气变为固态碘,导致反应物浓度降低,平衡逆向移动 30 pH越低,吸光度越高或pH越高,吸光度越低 c(H+)增大,ClO-氧化性增强,会继续将I2进一步氧化,c(I2)降低,吸光度下降
【解析】
(1)①用盖斯定律计算Q;
②利用ΔH=反应物总键能![]() 生成物总键能,求H—H键能;
生成物总键能,求H—H键能;
(2)①通过表中数据、按要求计算反应在前20min内的I2(g)平均速率![]() (I2);
(I2);
②在H2(g)+I2(g)![]() 2HI(g)中,温度为716K时,正反应速率v正=k正·c(H2)·c(I2)等于逆反应速率=v逆=k逆·c2(HI),处于平衡状态,据此可计算;
2HI(g)中,温度为716K时,正反应速率v正=k正·c(H2)·c(I2)等于逆反应速率=v逆=k逆·c2(HI),处于平衡状态,据此可计算;
③H2(g)+I2(g)![]() 2HI(g)达平衡后,降低温度,平衡可能逆向移动的原因从体系内存在的其它变化来分析(此反应中逆反应为吸热方向);
2HI(g)达平衡后,降低温度,平衡可能逆向移动的原因从体系内存在的其它变化来分析(此反应中逆反应为吸热方向);
(3)①pH=4.8时,据图判断c(I2)最大的时间;
②10min时,不同pH与吸光度的关系可通过该图数据分析得出;
③pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能从物质的性质来分析;
(1)①设反应①H2(g)+I2(g)=2HI(g) ΔH=QkJ·mol-1,反应②H2(g)+I2(s)=2HI(g) ΔH=+26.48kJ·mol-1,变化③I2(g)=I2(s) ΔH=-37.48kJ·mol-1,则反应①=反应②+变化③,故Q=-37.48+26.48=-11;
答案为:-11;
②按以上计算,则H2(g)+I2(g)=2HI(g) ΔH=-11kJ·mol-1,利用ΔH=反应物总键能![]() 生成物总键能=x+151-2×299=-11,x=436;
生成物总键能=x+151-2×299=-11,x=436;
答案为:436;
(2)①按题意知: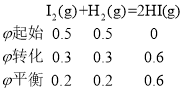 、则反应在前20min内的I2(g)平均速率
、则反应在前20min内的I2(g)平均速率![]() (I2)=
(I2)=![]() = 0.015p kPa·min-1;
= 0.015p kPa·min-1;
答案为:0.015p;
②在H2(g)+I2(g)![]() 2HI(g)中,温度为716K体系处于平衡状态时,v正=k正·c(H2)·c(I2) =v逆=k逆·c2(HI),则
2HI(g)中,温度为716K体系处于平衡状态时,v正=k正·c(H2)·c(I2) =v逆=k逆·c2(HI),则![]() ,图示平衡时
,图示平衡时 ![]() ,则
,则![]() ,则
,则![]() =
=![]() 或
或![]() ;
;
答案为:![]() 或
或![]() ;
;
③H2(g)+I2(g)![]() 2HI(g)为放热反应,若达平衡后物质状态及反应没有变化,则降低温度,平衡应该右移,现在逆向移动,则可能的原因从体系内存在的其它变化来分析,可能原因为:降温使碘蒸气变为固态碘,导致反应物浓度降低,平衡逆向移动;
2HI(g)为放热反应,若达平衡后物质状态及反应没有变化,则降低温度,平衡应该右移,现在逆向移动,则可能的原因从体系内存在的其它变化来分析,可能原因为:降温使碘蒸气变为固态碘,导致反应物浓度降低,平衡逆向移动;
答案为:降温使碘蒸气变为固态碘,导致反应物浓度降低,平衡逆向移动;
(3)①吸光度越高表明该体系中c(I2)越大,可由图知pH=4.8时,c(I2)最大的时间为30min;
答案为:30;
②吸光度越高表明该体系中c(I2)越大,10min时,![]() ,10 min时pH越低c(H+)越大,反应速率加快,c(I2)越高,吸光度越大;
,10 min时pH越低c(H+)越大,反应速率加快,c(I2)越高,吸光度越大;
答案为:pH越低,吸光度越高或pH越高,吸光度越低;
③pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降即c(I2)快速下降,也就是进一步反应了,这是因为c(H+)增大,ClO-氧化性增强,会继续将I2进一步氧化;
答案为:c(H+)增大,ClO-氧化性增强,会继续将I2进一步氧化,c(I2)降低,吸光度下降。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案