题目内容
【题目】如图是制取氯气并进行氯气性质实验的装置;装置中C、D均为洗气瓶,E瓶中有干燥的有色布条,F管中有铜丝,右端导管有脱脂棉,G瓶为集气瓶吸收装置。试回答:
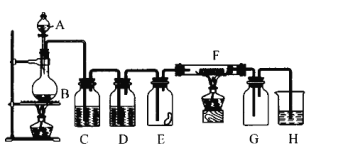
(1)C中试剂是___,作用是___,D中试剂是___,作用是___。
(2)E中的现象是___;F中的化学方程式为___,现象是___;脱脂棉的作用___。
(3)制取氯气的反应原理用化学方程式表示___。
(4)H中试剂是___,作用是___。
【答案】饱和NaCl溶液 除去氯气中少量的氯化氢气体 浓硫酸 除水 无明显现象 Cu+Cl2![]() CuCl2 由棕黄色的烟产生 防止氯化铜固体小颗粒堵塞试管 MnO2+4HCl(浓)
CuCl2 由棕黄色的烟产生 防止氯化铜固体小颗粒堵塞试管 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O NaOH溶液 吸收尾气
MnCl2+Cl2↑+2H2O NaOH溶液 吸收尾气
【解析】
实验室通常用二氧化锰与浓盐酸共热制取,生成的氯气中含有HCl、水蒸气杂质,需要饱和食盐水除HCl、浓硫酸干燥;装置E、F为性质验证,装置H为尾气处理。
(1)根据实验目的,C为饱和食盐水,为了吸收挥发出的HCl气体;试剂D为浓硫酸,为干燥氯气;
(2)干燥的氯气无漂白性,则E中的现象是无明显现象;氯气与Cu在加热的条件下生成棕黄色的氯化铜固体,方程式为Cu+Cl2![]() CuCl2;脱脂棉可防止氯化铜颗粒进入导管,造成堵塞;
CuCl2;脱脂棉可防止氯化铜颗粒进入导管,造成堵塞;
(3)实验室用二氧化锰与浓盐酸共热制取,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(4)氯气有毒,不能直接排放到大气中,装置H为吸收氯气的装置,盛有的试剂为NaOH溶液。

【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)已知:
H2(g)+I2(g)=2HI(g) ΔH=QkJ·mol-1
H2(g)+I2(s)=2HI(g) ΔH=+26.48kJ·mol-1
I2(g)=I2(s) ΔH=-37.48kJ·mol-1
化学键 | I—I | H—I |
键能/(kJ·mol-1) | 151 | 299 |
键能是将1mol气体分子AB断裂为中性气态原子A和B所需要的能量,单位为kJ·mol-1。
①Q=____kJ·mol-1。
②H—H键能为____kJ·mol-1。
(2)716K时,在恒容密闭容器中按物质的量之比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如图:
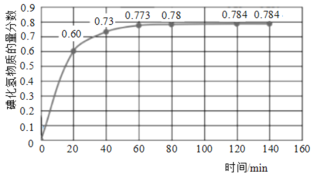
①若反应开始时气体混合物的总压为pkPa,则反应在前20min内的I2(g)平均速率![]() (I2)=___kPa·min-1(用含p的式子表示)。
(I2)=___kPa·min-1(用含p的式子表示)。
②在H2(g)+I2(g)![]() 2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,
2HI(g) ΔH=QkJ·mol-1反应中,正反应速率为v正=k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数,则温度为716K时,![]() =___(列出计算式)。
=___(列出计算式)。
③H2(g)+I2(g)![]() 2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是___。
2HI(g)达平衡后,降低温度,平衡可能逆向移动,原因是___。
(3)一定条件下,NaClO可将溶液中的I-氧化为I2。通过测定体系的吸光度,检测到不同pH下I2的生成量随时间的变化关系如图。
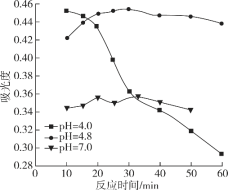
已知:吸光度越高表明该体系中c(I2)越大。
①pH=4.8时,在___min附近c(I2)最大。
②10min时,不同pH与吸光度的关系是___。
③pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因是___。