题目内容
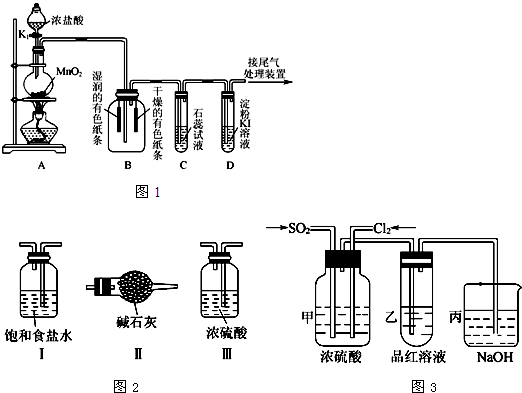
实验室制备Cl2时,反应物即使在停止加热后还会继续反应一段时间,当要收集多瓶Cl2时,常有较多的Cl2逸散.为了防止多余的Cl2逸散到空气中,并使Cl2随时取用,有人设计了如图甲装置来制取Cl2.
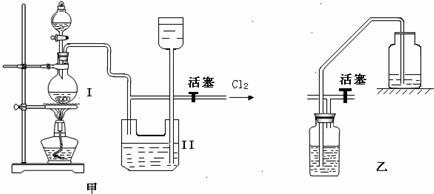
(1)甲装置Ⅱ是利用______原理设计的.当关闭活塞时,产生的氯气将Ⅱ中下方容器内的液体______,这样既可达到______目的,又可防止多余的Cl2逸散到空气中,从而使装置达到随时取用Cl2的目的.
(2)甲装置Ⅱ中盛有的液体是______.
(3)甲装置Ⅱ______(填“能”或“不能”)用乙装置来代替.
(4)甲装置Ⅰ中反应的化学方程式为______.
(5)实验室多余Cl2用______吸收,反应的离子方程式为______.

(1)甲装置Ⅱ是利用______原理设计的.当关闭活塞时,产生的氯气将Ⅱ中下方容器内的液体______,这样既可达到______目的,又可防止多余的Cl2逸散到空气中,从而使装置达到随时取用Cl2的目的.
(2)甲装置Ⅱ中盛有的液体是______.
(3)甲装置Ⅱ______(填“能”或“不能”)用乙装置来代替.
(4)甲装置Ⅰ中反应的化学方程式为______.
(5)实验室多余Cl2用______吸收,反应的离子方程式为______.
(1)分析装置特征,甲中Ⅱ装置是储气装置,关闭活塞利用气体压强增大,把液体压入上方容器,达到储气目的,需要氯气时,打开活塞使装置达到随时取用Cl2的目的,
故答案为:压强差,压入上方的容器内,储存氯气;
(2)浓盐酸具有挥发性,加热更促进了浓盐酸的挥发,所以制取的氯气中含有氯化氢气体,氯化氢极易溶于水,氯气和水也反应,所以不能用水吸收氯化氢气体;饱和食盐水中含有氯离子,所以能抑制氯气和水的反应降低氯气的溶解度,故甲中Ⅱ中盛有的液体是饱和食盐水,
故答案为:饱和食盐水;
(3)甲中装置Ⅱ和乙装置都是通过排出液体贮存气体的装置,所以能代替,
故答案为:能;
(4)甲装置Ⅰ中反应是实验室制备氯气的装置,二氧化锰和浓盐酸加热反应制备氯化锰、氯气和水,反应的化学方程式为:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(5)氯气是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:NaOH溶液,Cl2+2OH-=ClO-+Cl-+H2O;
故答案为:压强差,压入上方的容器内,储存氯气;
(2)浓盐酸具有挥发性,加热更促进了浓盐酸的挥发,所以制取的氯气中含有氯化氢气体,氯化氢极易溶于水,氯气和水也反应,所以不能用水吸收氯化氢气体;饱和食盐水中含有氯离子,所以能抑制氯气和水的反应降低氯气的溶解度,故甲中Ⅱ中盛有的液体是饱和食盐水,
故答案为:饱和食盐水;
(3)甲中装置Ⅱ和乙装置都是通过排出液体贮存气体的装置,所以能代替,
故答案为:能;
(4)甲装置Ⅰ中反应是实验室制备氯气的装置,二氧化锰和浓盐酸加热反应制备氯化锰、氯气和水,反应的化学方程式为:
MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
(5)氯气是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,
故答案为:NaOH溶液,Cl2+2OH-=ClO-+Cl-+H2O;

练习册系列答案
相关题目

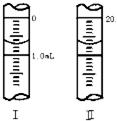
 ,请在方框内写出导致该阶段颜色变化的粒子符号.
,请在方框内写出导致该阶段颜色变化的粒子符号.