题目内容
在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+
2Mn2++10CO2↑+8H2O
(1)若用托盘天平称取WgNa2C2O4晶体,称量时需移动游码,应用______(填工具名称)拨动游码.
(2)若将WgNa2C2O4配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性KMnO4溶液应装在______(填“酸式”或“碱式”)滴定管中,需要润洗的是______(填“滴定管”或“锥形瓶”).判断滴定达到终点的现象是______.
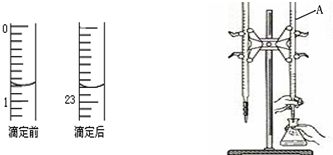
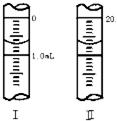
(3)若滴定管的起始读数和终点读数如图,则酸性KMnO4溶液消耗的体积为______mL,KMnO4溶液的物质的量浓度为______mol/L(填表达式).
| ||
(1)若用托盘天平称取WgNa2C2O4晶体,称量时需移动游码,应用______(填工具名称)拨动游码.
(2)若将WgNa2C2O4配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性KMnO4溶液应装在______(填“酸式”或“碱式”)滴定管中,需要润洗的是______(填“滴定管”或“锥形瓶”).判断滴定达到终点的现象是______.
(3)若滴定管的起始读数和终点读数如图,则酸性KMnO4溶液消耗的体积为______mL,KMnO4溶液的物质的量浓度为______mol/L(填表达式).

(1)用托盘天平称取W g Na2C2O4晶体,称量时需移动游码,应用镊子拨动游码,故答案为:镊子;
(2)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应装在酸式滴定管中;
滴定管应该是先用蒸馏水润洗,然后用待测液润洗,否则所装液体被稀释;
KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色为滴定到终点,
故答案为:酸式;滴定管;滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色;
(3)滴定管的起始读数为0.70mL,终点读数为20.70mL,酸性KMnO4溶液消耗的体积为20.70mL-0.70mL=20.00mL;
KMnO4溶液的物质的量浓度为c,WgNa2C2O4配成100mL标准溶液,20.00mL溶液中含有Na2C2O4
g;
2KMnO4 ~5Na2C2O4
2 5×134g
0.02L×c;
g
=
,
解得:c=
mol?L-1,
故答案为:22.00;
.
(2)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应装在酸式滴定管中;
滴定管应该是先用蒸馏水润洗,然后用待测液润洗,否则所装液体被稀释;
KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色为滴定到终点,
故答案为:酸式;滴定管;滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色;
(3)滴定管的起始读数为0.70mL,终点读数为20.70mL,酸性KMnO4溶液消耗的体积为20.70mL-0.70mL=20.00mL;
KMnO4溶液的物质的量浓度为c,WgNa2C2O4配成100mL标准溶液,20.00mL溶液中含有Na2C2O4
| W |
| 5 |
2KMnO4 ~5Na2C2O4
2 5×134g
0.02L×c;
| W |
| 5 |
| 2 |
| 0.02L×c |
| 5×134 | ||
|
解得:c=
| 2W |
| 67 |
故答案为:22.00;
| 2W |
| 67 |

练习册系列答案
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目