题目内容
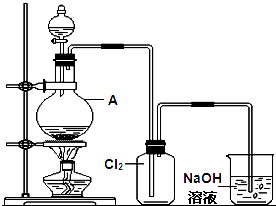
某课外活动小组设计如图1所示装置,进行氯气制备及有关性质验证的实验.
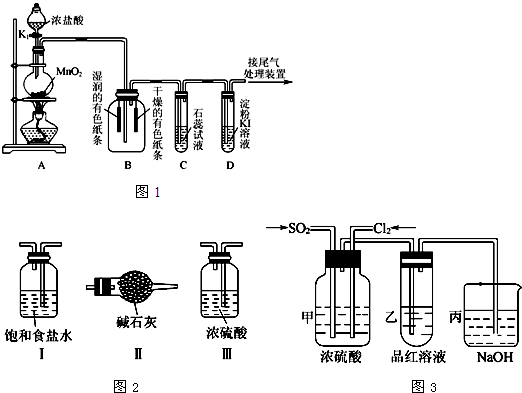
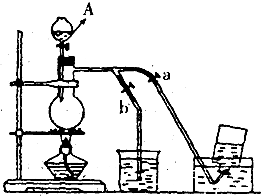
(1)在实验时打开A中分液漏斗的活塞后,漏斗中的液体没有顺利流下,其可能原因是______,装置A中发生反应的离子方程式为______.
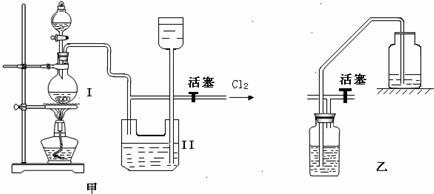
(2)上述装置中明显存在不足之处,为保证装置B中实验成功,应在装置A、B之间添加一个装置,该装置是图2中的______(填“Ⅰ”、“Ⅱ”或“Ⅲ”).
(3)装置C中溶液发生的颜色变化为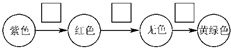 ,请在方框内写出导致该阶段颜色变化的粒子符号.
,请在方框内写出导致该阶段颜色变化的粒子符号.
(4)装置D中起始的实验现象是______.
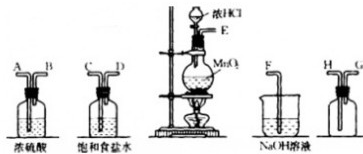
(5)某同学认为SO2和Cl2都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果没有预期那样快.为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如图3所示实验装置.
①实验开始后,乙装置中出现的现象是______;
②用离子方程式表示乙中产生该现象的原因:______.

(1)在实验时打开A中分液漏斗的活塞后,漏斗中的液体没有顺利流下,其可能原因是______,装置A中发生反应的离子方程式为______.
(2)上述装置中明显存在不足之处,为保证装置B中实验成功,应在装置A、B之间添加一个装置,该装置是图2中的______(填“Ⅰ”、“Ⅱ”或“Ⅲ”).
(3)装置C中溶液发生的颜色变化为
 ,请在方框内写出导致该阶段颜色变化的粒子符号.
,请在方框内写出导致该阶段颜色变化的粒子符号.(4)装置D中起始的实验现象是______.
(5)某同学认为SO2和Cl2都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果没有预期那样快.为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如图3所示实验装置.
①实验开始后,乙装置中出现的现象是______;
②用离子方程式表示乙中产生该现象的原因:______.
(1)在实验时打开A中分液漏斗的活塞后,漏斗中的液体没有顺利流下,其可能原因是分液漏斗上口玻璃塞未打开或活塞上小孔和槽口未对齐;装置图分析可知A中是氯气的发生装置,利用二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
故答案为:分液漏斗上口玻璃塞未打开,MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
(2)B装置是验证氯气是否具有漂白性的实验装置,干燥的氯气不能使干燥的有色布条褪色,能使湿润的有色布条褪色,所以为防止氯气中的水蒸气干扰实验验证,需要对氯气进行干燥选择Ⅲ能实现实验目的;
故答案为:Ⅲ;
(3)氯气通入紫色石蕊试液,氯气和水反应生成盐酸和次氯酸,盐酸能使石蕊试液变红色,次氯酸具有漂白性能使红色褪色,氯气溶解于水,溶液呈浅黄绿色;使石蕊变红的微粒为H+,红色褪去的微粒为HClO,溶液呈浅绿色为Cl2;
故答案为:H+、HClO、Cl2;
(4)氯气通入淀粉碘化钾溶液中氧化碘离子为单质碘,Cl2+2I-=I2+2Cl-,碘遇到淀粉变蓝;
故答案为:淀粉KI溶液变蓝;
(5)①干燥的氯气和二氧化硫气体一起通入品红溶液中按照1:1发生反应生成硫酸和盐酸,所以品红红色不褪色;
故答案为:品红溶液不褪色;
②氯气和二氧化硫一起通过品红试液发生氧化还原反应生成硫酸和盐酸,反应的离子方程式为:Cl2+SO2+2H2O═4H++SO42-+2Cl-;
故答案为:Cl2+SO2+2H2O═4H++SO42-+2Cl-;
| ||
故答案为:分液漏斗上口玻璃塞未打开,MnO2+4H++2Cl-
| ||
(2)B装置是验证氯气是否具有漂白性的实验装置,干燥的氯气不能使干燥的有色布条褪色,能使湿润的有色布条褪色,所以为防止氯气中的水蒸气干扰实验验证,需要对氯气进行干燥选择Ⅲ能实现实验目的;
故答案为:Ⅲ;
(3)氯气通入紫色石蕊试液,氯气和水反应生成盐酸和次氯酸,盐酸能使石蕊试液变红色,次氯酸具有漂白性能使红色褪色,氯气溶解于水,溶液呈浅黄绿色;使石蕊变红的微粒为H+,红色褪去的微粒为HClO,溶液呈浅绿色为Cl2;
故答案为:H+、HClO、Cl2;
(4)氯气通入淀粉碘化钾溶液中氧化碘离子为单质碘,Cl2+2I-=I2+2Cl-,碘遇到淀粉变蓝;
故答案为:淀粉KI溶液变蓝;
(5)①干燥的氯气和二氧化硫气体一起通入品红溶液中按照1:1发生反应生成硫酸和盐酸,所以品红红色不褪色;
故答案为:品红溶液不褪色;
②氯气和二氧化硫一起通过品红试液发生氧化还原反应生成硫酸和盐酸,反应的离子方程式为:Cl2+SO2+2H2O═4H++SO42-+2Cl-;
故答案为:Cl2+SO2+2H2O═4H++SO42-+2Cl-;

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目