题目内容
4.下列有关水的认识,你认为正确的是( )| A. | 用自来水烧开水热水壶底常沉积一层水垢,说明蒸馏水不是纯净物 | |
| B. | 用自来水配制的硝酸银溶液出现浑浊现象,说明自来水中含有氯化银杂质 | |
| C. | 用蒸馏的方法可以从海水中提取淡水,说明水和食盐的沸点不同 | |
| D. | 少量水洒到烧旺的煤炉中火焰会更猛烈,说明一定条件下水能燃烧 |
分析 A.自来水不等于蒸馏水,蒸馏水为纯净物;
B.生成氯化银,说明自来水中含有氯离子;
C.蒸馏用于分离沸点不同的物质;
D.少量水在高温下与碳反应生成CO和氢气.
解答 解:A.用自来水烧开水热水壶底常沉积一层水垢,说明自来水中溶解可生成水垢的物质,则自来水为混合物,而自来水不等于蒸馏水,蒸馏水为纯净物,故A错误;
B.一般来说自来水用氯气消毒,生成氯化银,说明自来水中含有氯离子,故B错误;
C.蒸馏用于分离沸点不同的物质,从海水中提取淡水,可说明水和食盐的沸点不同,故C正确;
D.少量水在高温下与碳反应生成CO和氢气,燃烧更旺,但水不燃烧,如加入较多量的水,则水扑灭,故D错误.
故选C.
点评 本题考查物质的分离提纯以及检验,侧重于化学与生活的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
相关题目
14.对下列图象的描述中,正确的是( )
| A. |  根据图可判断正反应的△H<0 | |
| B. |  根据图,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5 | |
| C. | 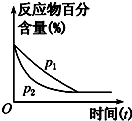 图可表示压强(p)对反应2A(g)+2B(g)?3C(g)+D(s)的影响 | |
| D. |  图为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
15.用水就能鉴别的一组物质是( )
| A. | 乙烯、乙炔 | B. | 乙酸、乙醛 | C. | 苯、甲苯 | D. | 己烷、乙醇 |
12.利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
| A. | 电解时可以精铜为阳极,以CuSO4溶液为电解液 | |
| B. | 电解时阴极发生还原反应 | |
| C. | 粗铜连接电源负极,其电极反应是Cu-2e-=Cu2+ | |
| D. | 电解结束后,电解质溶液的浓度保持不变 |
19.下列哪种物质不属于以石油、煤和天然气为主要原料生产的三大合成材料是( )
| A. | 合成橡胶 | B. | 塑料 | C. | 合成纤维 | D. | 陶瓷 |
9.最新卫星测量结果显示,南、北极冰层融化加速,造成这种现象的主要原因是( )
| A. | 二氧化碳增多使太阳辐射到地球表面的能量增多 | |
| B. | 二氧化碳等气体能释放能量,使大气层的温度升高 | |
| C. | 氟氯烃等大量排放,破坏臭氧层引起的 | |
| D. | 二氧化碳、甲烷等温室气体产生温室效应,使大气温度升高,加速冰层融化 |
16.海水淡化大多采用的方法是( )
| A. | 蒸馏 | B. | 过滤 | C. | 萃取 | D. | 电渗析法 |
13.氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛.
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为同分异构体;氰酸铵属于离子化合物(选填:“离子”或“共价”).
(2)液氨是一种贮氢材料,气态氨转变为液氨将释放能量(选填:“吸收”或“释放”).液氨可通过图1装置释放氢气,该过程中能量转化方式为电能转化为化学能.
(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)?5N2(g)+6H2O(g).
①能说明该反应已达到平衡状态的标志是bc(不定项选择).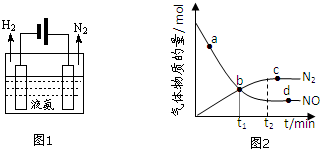
a.反应速率ν( NH3)=ν( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图2所示,图中ν(正)与ν(逆)相等的点为cd(选填字母).
(4)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
则合成氨反应:N2(g)+3H2 (g)═2NH3(g)△H=-90.8kJ•mol-1
(5)工业上用氨水吸收硫酸工业尾气中的SO2,既可消除污染又可获得NH4HSO3等产品.若用1000kg 含NH3质量分数为17%的氨水吸收SO2且全部转化为NH4HSO3,不考虑其它成本,则可获得的利润为782元(参照下面的价格表).
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为同分异构体;氰酸铵属于离子化合物(选填:“离子”或“共价”).
(2)液氨是一种贮氢材料,气态氨转变为液氨将释放能量(选填:“吸收”或“释放”).液氨可通过图1装置释放氢气,该过程中能量转化方式为电能转化为化学能.
(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)?5N2(g)+6H2O(g).
①能说明该反应已达到平衡状态的标志是bc(不定项选择).

a.反应速率ν( NH3)=ν( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图2所示,图中ν(正)与ν(逆)相等的点为cd(选填字母).
(4)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
| 共价键 | H-H | N-H | N≡N |
| 能量变化/kJ•mol-1 | 436 | 390.8 | 946 |
(5)工业上用氨水吸收硫酸工业尾气中的SO2,既可消除污染又可获得NH4HSO3等产品.若用1000kg 含NH3质量分数为17%的氨水吸收SO2且全部转化为NH4HSO3,不考虑其它成本,则可获得的利润为782元(参照下面的价格表).
| NH3质量分数17%的氨水 | 无水NH4HSO3 | |
| 价格(元/kg) | 1.0 | 1.8 |
15.如图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法错误的是( )
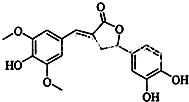

| A. | 分子中含有三种含氧官能团 | |
| B. | 1 mol 该化合物与NaOH(aq) 反应,最多消耗量4 mol NaOH | |
| C. | 既可以发生取代反应,又能够发生加成反应 | |
| D. | 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2 |