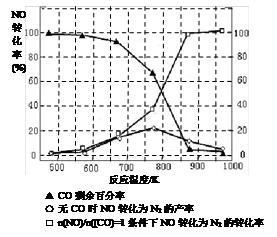
题目内容
已知:HCN(aq)与NaOH(aq)反应的△H=" -12.1kJ" /mol;HCl(aq)与NaOH(aq)反应的△H =" -55.6kJ/" mol。则HCN在水溶液中电离的ΔH等于
| A.-67.7 kJ /mol | B.-43.5kJ /mol |
| C.+43.5 kJ/ mol | D.+67.7 kJ/ mol |
C
弱电解质的电离是吸热反应,根据盖斯定律,两式相减得C。

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
 CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.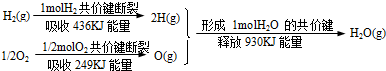
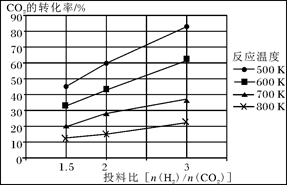
 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)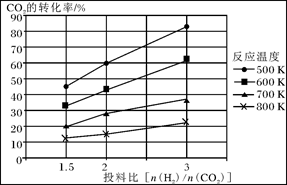
 2SO3(g) ΔH1 平衡常数为K1
2SO3(g) ΔH1 平衡常数为K1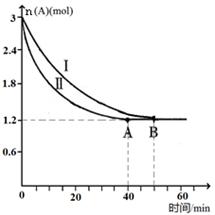
 CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1

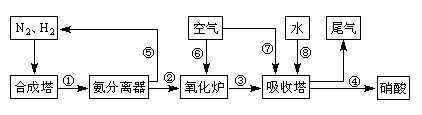
 CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。