��Ŀ����
����Ŀ����ҵ�Ի�ͭ����Ҫ�ɷ���CuFeS2��Ϊԭ���Ʊ���ͭ����һ���Դ�ͭΪԭ���Ʊ�CuSO4��5H2O���塣�����������£����ֲ����������ԣ���
I. ���ջ�ͭ�õ���ͭ������������ͭ�Ļ�����ȣ���
II. ���ͭ�м���ϡH2SO4��ϡHNO3����ʹ������NO��H2O��O2��Ӧ��
III. ���ڢ���������Һ��pH�����ˣ�
��. ��������ҺŨ������ȴ�ᾧ�����ˣ��õ�CuSO4��5H2O���塣
��֪���������������pH
Cu��OH��2 | Fe��OH��3 | |
��ʼ����ʱ | 4.8 | 1.5 |
��ȫ����ʱ | 6.7 | 2.8 |
ע���������ӵ���ʼŨ��Ϊ0.1 mol��L
��ش�
��1��I����Ҫ��������������ѧ��Ӧ���뽫��Ӧii�Ļ�ѧ����ʽ����������
i. 2CuFeS2+4O2![]() Cu2S+3SO2+2FeO
Cu2S+3SO2+2FeO
ii. ![]() Cu2S+
Cu2S+![]() O2
O2 ![]()
![]() _________+
_________+ ![]() SO2
SO2
��2��II��NO��H2O��O2��Ӧ�Ļ�ѧ����ʽ��_________��
��3��III�е�������Ҫ��Fe��OH��3��������Һ��pHʱ��pH��Χ��_________��
��4���й��������̵�˵���У���ȷ����_________������ţ���
a. I��β������SO2�����ۺ������Ʊ�H2SO4��
b. II��ϡHNO3������֮һ��ʹCu����ת��ΪCu2+
c. �����������У�HNO3��ѭ������
���𰸡�1�� 1�� 2Cu�� 14NO+3O2+2H2O=4HNO32.8~4.8a b c
��������
��1��������֪���ջ�ͭ�õ���ͭ����Ӧii������ͭ�ڿ������������ɶ��������ͭ�����������ԭ��Ӧ�Է���ʽ������ƽ�÷�ӦCu2S+ O2![]() 2Cu+ SO2��
2Cu+ SO2��
��2��II��NO��H2O��O2��Ӧ���յõ����ᣬ��Ӧ�Ļ�ѧ����ʽ��4NO+3O2+2H2O=4HNO3��
��3��III�е�������Ҫ��Fe��OH��3��������Һ��pHʱ������ʹ��������ȫ������ͭ���ӻ�û��ʼ��������pH��Χ��2.8~4.8��
��4��a. I��β������SO2�����ö��������������������õ�������������������ˮ��Ӧ�������ᣬ����ۺ�����SO2�Ʊ�H2SO4������ȷ��b. ͭ��ϡ�����Ӧ����II��ϡHNO3������֮һ��ʹCu����ת��ΪCu2+������ȷ��c. �����������У�HNO3��ͭ��Ӧ���ɵ�NO��ת��ΪHNO3����HNO3��ѭ�����ã�����ȷ����ѡa b c��

����Ŀ����0.2 mol��L-1��KI��Һ��0.05 mol��L-1Fe2(SO4)3��Һ�������Ϻ�ȡ���Һ�ֱ��������ʵ�飬��˵����Һ�д��ڻ�ѧƽ����2Fe3++2I��![]() 2Fe2++I2������
2Fe2++I2������
ʵ���� | ʵ����� | ʵ������ |
�� | ����KSCN��Һ | ��Һ���ɫ |
�� | ����AgNO3��Һ | �л�ɫ�������� |
�� | ����K3[Fe(CN)6]��Һ | ����ɫ�������� |
�� | ���������Һ | ��Һ����ɫ |
A. ������ B. ������ C. ������ D. ������
����Ŀ��������Դ�ḻ����ˮˮ��Դ�����úͺ�ˮ��ѧ��Դ����ҪΪNaCl��MgSO4��K��Br��Ԫ���������þ��зdz�������ǰ����

�ش��������⣺
��1��NaCl ��Һ�ɴ���ˮ���ƶ��ɣ�Ϊ��ȥMg2+��Ca2+��Ҫ������Լ��ֱ�Ϊ__________________��__________________��
��2��д���������з�Ӧ���ܻ�ѧ����ʽΪ___________________________________��
��3��������������������KClO3���������������������ԭ����_____________________________��
��4����֪MgCl2��Һ����ʱ��ˮ������Mg(OH)Cl��д���ù��̵Ļ�ѧ����ʽ__________________��
��5��Ϊ�õ���ˮMgCl2���������IJ���ӦΪ_____________________________��
��6���������У��������MgCl2�õ���þ��Ҫ�ڱ���������ȴ���������������Ϊ����������_____��
A.N2 B.H2 C. CO2 D.����
��7����ˮ���庬��Ϊ65mg��L-1����1L��ˮ��95%��Ԫ�ر�����ΪBr2���ȿ����������嵥�ʲ�����3%�������SO2��90%Br2��ԭ��Br-��������Һ���Ϊ50mL���˹��̵�Ŀ��Ϊ________________��������Һ��������Ũ��Ϊ��ˮ��������Ũ�ȵ�_____________������ȷ��0.1����
���𰸡� NaOH ��Һ Na2CO3��Һ Cl-+3H2O![]() ClO3-+3H2�� ���¶��� KClO3�ܽ����С MgCl2+H2O
ClO3-+3H2�� ���¶��� KClO3�ܽ����С MgCl2+H2O![]() Mg(OH)Cl+HCl�� ͨ���Ȼ��⣬����Ũ����ȴ�ᾧ B �����ˮ��Ũ�� 16.6��
Mg(OH)Cl+HCl�� ͨ���Ȼ��⣬����Ũ����ȴ�ᾧ B �����ˮ��Ũ�� 16.6��
�������������������1����ȥMg2+��Ca2+������������������þ��̼��Ƴ����ķ�������2�����ݵ����غ㣬�������е���Ȼ�����Һ�����������ơ���������3�������� KClO3�ܽ����С����4��MgCl2��Һ����ʱ��ˮ������Mg(OH)Cl��HCl��������5��ͨ���Ȼ�����������Ȼ�þˮ������6�����ݽ���þ�����ʷ�������7��1L��ˮ��95%��Ԫ��ת�Ƶ�50mL��Һ����Ŀ�������ˮ��Ũ�ȣ�������Ԫ���غ����������Ũ����
��������1��NaCl ��Һ�ɴ���ˮ���ƶ��ɣ�Ϊ��ȥMg2+��Ca2+�����Լ�������������Һ��̼������Һ����2�����ݵ����غ㣬�������е���Ȼ�����Һ�����������ơ���������Ӧ���ܻ�ѧ����ʽΪCl-+3H2O![]() ClO3-+3H2������3�������� KClO3�ܽ����С����������������Һ�м����Ȼ���������KClO3�����������������������4��MgCl2��Һ����ʱ��ˮ������Mg(OH)Cl��HCl���壬��Ӧ�Ļ�ѧ����ʽ��MgCl2+H2O
ClO3-+3H2������3�������� KClO3�ܽ����С����������������Һ�м����Ȼ���������KClO3�����������������������4��MgCl2��Һ����ʱ��ˮ������Mg(OH)Cl��HCl���壬��Ӧ�Ļ�ѧ����ʽ��MgCl2+H2O![]() Mg(OH)Cl+HCl������5��ͨ���Ȼ�����������Ȼ�þˮ����Ϊ�õ���ˮMgCl2���������IJ���ӦΪͨ���Ȼ��⣬����Ũ����ȴ�ᾧ����6��A.Mg��N2��Ӧ����Mg3N2����A������ B.H2��Mg����Ӧ����B��ȷ�� C. CO2��Mg��Ӧ��������þ��̼����C���� D.þ�ڿ�������ȼ������D������7��1L��ˮ��95%��Ԫ��ת�Ƶ�50mL��Һ����Ŀ�������ˮ��Ũ�ȣ���������Һ��������Ũ��Ϊx mg��L-1��������Ԫ���غ���
Mg(OH)Cl+HCl������5��ͨ���Ȼ�����������Ȼ�þˮ����Ϊ�õ���ˮMgCl2���������IJ���ӦΪͨ���Ȼ��⣬����Ũ����ȴ�ᾧ����6��A.Mg��N2��Ӧ����Mg3N2����A������ B.H2��Mg����Ӧ����B��ȷ�� C. CO2��Mg��Ӧ��������þ��̼����C���� D.þ�ڿ�������ȼ������D������7��1L��ˮ��95%��Ԫ��ת�Ƶ�50mL��Һ����Ŀ�������ˮ��Ũ�ȣ���������Һ��������Ũ��Ϊx mg��L-1��������Ԫ���غ��� ![]() ��x=1078.2��������Һ��������Ũ��Ϊ��ˮ��������Ũ�ȵ�
��x=1078.2��������Һ��������Ũ��Ϊ��ˮ��������Ũ�ȵ�![]() 16.6����
16.6����
�����͡�������
10
����Ŀ��̼����Ԫ�ؼ��仯���������������������������ء�
I���ȵĻ�����ϳɡ�ת��һֱ�ǿ�ѧ�о����ȵ㡣
��1��һ�������£������백����Ӧ�����Ʊ��Ȱ�(NH2Cl)���壬��֪���ֻ�ѧ���ļ�����
��ѧ�� | N��H | CI��Cl | N��Cl | H��Cl |
����/ kJmol-1 | 391.3 | 243.0 | 191.0 | 431.8 |
��������Ӧ���Ȼ�ѧ����ʽΪ��__________________��
��2���Ȱ�(g)��һ�ֳ�Ч���ͺ������������л������־õ�ɱ�����ã�����ɱ��H7N9�����в�����������ԭ��Ϊ��ˮ������Ӧ����ǿ�����Ե����ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ______________________��
II.̼�Ļ������ת���������������о�����Ҫ��Ӧ�á��ر���CO2�ĵ�̼ת�ͶԵ�������仯������Ҫ���塣
��1���������ݻ���Ϊ1L���ܱ��������Բ�ͬ����̼��![]() ����H2��CO2����һ�������·�����Ӧ��2CO2(g)+6H2(g)
����H2��CO2����һ�������·�����Ӧ��2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ��H��CO2��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
C2H4(g)+4H2O(g) ��H��CO2��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
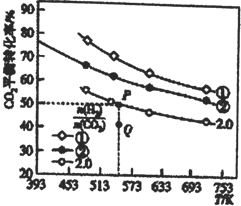
��ش�����������
����̼����________����Q��V(��)___v(��)���÷�Ӧ����H ________0������������������С������
������ʼʱ��CO2��H2��Ũ�ȷֱ�Ϊ0.5mol��L-1��l mol��L-1����P���Ӧ�¶ȵ�ƽ�ⳣ����ֵΪ_____��P���Ӧ��ƽ�ⳣ��__________Q���Ӧ��ƽ�ⳣ�������������������=����
��2����֪��̼��H2CO3��K1=4.3��10-7��K2=5.6��10-11
����H2C2O4��K1=6.0��10-2��K2=6.0��10-5
�����������Դ����������___________������ĸ����
a.H2CO3��C2O42- b.CO32-��HC2O4- c. C2O42-��HCO3- d.H2C2O4��HCO3-
�����������ʵ���Ũ�ȵIJ�����Һ��̼����Һ�������ϣ���Һ�и�������(��OH-��)Ũ���ɴ�С��˳����_________________________________��