题目内容
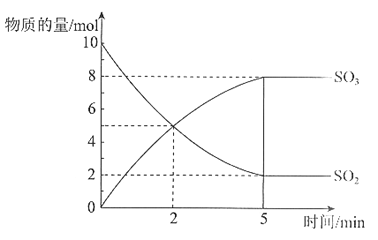
【题目】在2 L的密闭容器中,SO2和O2在催化剂500℃的条件下发生反应。SO2和SO3的物质的量随时间变化的关系曲线如图所示。
回答下列问题。
(1)该反应的化学方程式是_________。
(2)在前2 min内,以SO2的浓度变化表示的速率是_________mol/(L·min)。
(3)反应达到平衡状态的依据是_________。
a. 单位时间内消耗1 mol SO2,同时生成1 mol SO3
b. SO2的浓度与SO3浓度均不再变化
c. SO2的浓度与SO3浓度相等
【答案】2SO2+O2 ![]() 2SO31.25b
2SO31.25b
【解析】
(1)SO2和O2在催化剂500℃的条件下发生反应生成SO3。该反应的化学方程式是2SO2+O2 ![]() 2SO3;
2SO3;
(2)根据曲线图可知,在前2 min内,以SO2的浓度变化表示的速率是![]() =1.25mol/(L·min);
=1.25mol/(L·min);
(3)可逆反应达到化学平衡状态的标志是正、逆反应速率相等、各组分浓度保持不变。a. 单位时间内消耗1 mol SO2,同时生成1 mol SO3,均为正反应,不能体现v(正)=v(逆),不是平衡状态;b. SO2的浓度与SO3浓度均不再变化,各组分浓度保持不变,说明反应达到平衡状态;c. SO2的浓度与SO3浓度相等为特殊情况,不能说明v(正)=v(逆),不是平衡状态;答案选b。

【题目】工业以黄铜矿(主要成分是CuFeS2)为原料制备粗铜,进一步以粗铜为原料制备CuSO4·5H2O晶体。工艺流程如下(部分操作和条件略):
I. 煅烧黄铜矿,得到粗铜(含铁及铁、铜的化合物等);
II. 向粗铜中加入稀H2SO4和稀HNO3,并使产生的NO与H2O、O2反应;
III. 调节Ⅱ中所得溶液的pH,过滤;
Ⅳ. 将Ⅲ中滤液浓缩后冷却结晶,过滤,得到CuSO4·5H2O晶体。
已知:生成氢氧化物的pH
Cu(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.8 | 1.5 |
完全沉淀时 | 6.7 | 2.8 |
注:金属离子的起始浓度为0.1 mol/L
请回答:
(1)I中主要发生如下两个化学反应。请将反应ii的化学方程式补充完整。
i. 2CuFeS2+4O2![]() Cu2S+3SO2+2FeO
Cu2S+3SO2+2FeO
ii. ![]() Cu2S+
Cu2S+![]() O2
O2 ![]()
![]() _________+
_________+ ![]() SO2
SO2
(2)II中NO与H2O、O2反应的化学方程式是_________。
(3)III中的滤渣主要是Fe(OH)3。调节溶液的pH时,pH范围是_________。
(4)有关上述过程的说法中,正确的是_________(填序号)。
a. I中尾气含有SO2,可综合利用制备H2SO4。
b. II中稀HNO3的作用之一是使Cu单质转化为Cu2+
c. 在上述过程中,HNO3可循环利用





