��Ŀ����
����Ŀ���йغ��������������ʵ�顣

��.ij�о���ѧϰС��������ͼװ���о���������ʡ�
ʵ��һ����ͬѧ����ͼװ����֤ʵϡ������ͭ��Ӧ����NO
��1����A����U�ι���ע��ϡ���������������___��
��2�������ռ�NO����ĸ���װ���У���������___��(����ţ���ѡ������)

��3����100mL�����Һ�У�HNO3��H2SO4�����ʵ���Ũ�ȷֱ���0.4mol/L��0.1mol/L����û��Һ�м���1.92gͭ�ۣ����ȴ���ַ�Ӧ��������Һ��Cu2�������ʵ���Ũ����__��
ʵ���������ͬѧ��������װ�����Ũ������ͭ�ķ�Ӧ
��4������ͬѧ����ʵ�������м�ƿŨ����ʻ�ɫ�����û�ѧ����ʽ�ͼ�����˵�������������� ___��
��.ijͬѧ����ͼʵ��װ��(���м�ʯ��Ϊ�����������ƺ���ʯ�ҵĻ����)��ȡ��������ش��������⣺

��5��д����ȡ�����Ļ�ѧ����ʽ��___��
���𰸡�U�ι��������ɫ���������Һ������Ҹ� CE 0.225mol/L �����ֽ⣬4HNO3![]() 4NO2����O2����2H2O�����ɵ�NO2�����������У�ʹ����ʻ�ɫ 2NH4Cl��Ca(OH)2
4NO2����O2����2H2O�����ɵ�NO2�����������У�ʹ����ʻ�ɫ 2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O
CaCl2��2NH3����2H2O
��������
ʵ��һ(1)ͭ��ϡ���ᷴӦ��������ͭ����ɫ����һ��������
(2)һ�������ж�����������Ӧ���ɶ���������һ����������ˮ��Ӧ�����Բ������ſ������ռ���Ӧ������ˮ���ռ���
(3)��û��Һ�м��� 1.92gͭ�ۣ���n��Cu��= ![]() =0.03mol��n��H+��=0.4mol/L��0.1L+0.1mol/L��2��0.1L=0.06mol��n��NO3-��=0.4mol/L��0.1L=0.04mol������3Cu+8H++2NO3-=3Cu2++2NO��+4H2O���жϹ������Բ�����������㣻
=0.03mol��n��H+��=0.4mol/L��0.1L+0.1mol/L��2��0.1L=0.06mol��n��NO3-��=0.4mol/L��0.1L=0.04mol������3Cu+8H++2NO3-=3Cu2++2NO��+4H2O���жϹ������Բ�����������㣻
ʵ���(4)����ȶ��ֽ�����Ķ��������ܽ����гʻ�ɫ��
(5)ʵ�������������ƺ��Ȼ���ڼ����������Ʊ��������������Ȼ��ơ�ˮ��
I��ʵ��һ(1)ͭ��ϡ���ᷴӦ��������ͭ����ɫ����һ��������U�ι��������ɫ�������������ѹǿ�����ã����Һ������Ҹߣ�
��Ϊ��U�ι��������ɫ���������Һ������Ҹߣ�
(2)һ�������ж�����������Ӧ���ɶ���������һ����������ˮ��Ӧ�����Բ������ſ������ռ���Ӧ������ˮ���ռ�����ˮװ���У�����Ľ����ڷ��ϡ��̽���������ԭ��CE��ȷ��
��ΪCE��
(3)n��Cu��=![]() =0.03mol��n��H+��=0.4mol/L��0.1L+0.1mol/L��2��0.1L=0.06mol��n��NO3-��=0.4mol/L��0.1L=0.04mol�������ķ�ӦΪ��
=0.03mol��n��H+��=0.4mol/L��0.1L+0.1mol/L��2��0.1L=0.06mol��n��NO3-��=0.4mol/L��0.1L=0.04mol�������ķ�ӦΪ��
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO��+ 4H2O
![]()
���ݷ�����֪�������ӵ����ʵ���0.06mol<0.08mol�����H+���㣬��H+Ϊ�����㣻�������ӵ����ʵ��������ӷ���ʽ��֪0.06mol�����Ӳμӷ�Ӧ�����ɵ�ͭ���ӵ����ʵ���Ϊ0.06mol��![]() =0.0225mol��������Һ��c��Cu2+��=
=0.0225mol��������Һ��c��Cu2+��=![]() =0.225mol/L��
=0.225mol/L��
����0.225mol/L��
ʵ���(4)����ȶ��ֽ�����Ķ��������ܽ������У���Һ�ʻ�ɫ����Ӧ����ʽΪ4HNO3��Ũ��![]() 4NO2��+O2��+2H2O��
4NO2��+O2��+2H2O��
��Ϊ��4HNO3��Ũ��![]() 4NO2��+O2��+2H2O�������Ķ��������ܽ����гʻ�ɫ��
4NO2��+O2��+2H2O�������Ķ��������ܽ����гʻ�ɫ��
��.(5)ʵ�������������ƺ��Ȼ���ڼ����������Ʊ���������Ӧ����ʽΪ2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3����
CaCl2+2H2O+2NH3����
����2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3����
CaCl2+2H2O+2NH3����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ij�о�С��̽����������泥�![]() ���ֽ�Ļ�ѧƽ���ˮ�ⷴӦ���ʡ���һ���������İ�����������ڹ̶��ݻ�Ϊ100mL���ܱ������ҺA�У��ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⡣ʵ���ò�ͬ�¶��µ�ƽ�����������±���
���ֽ�Ļ�ѧƽ���ˮ�ⷴӦ���ʡ���һ���������İ�����������ڹ̶��ݻ�Ϊ100mL���ܱ������ҺA�У��ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⡣ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶ȣ��棩 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ�����������ʵ�����mol�� | 0.34 | 0.48 | 0.68 | 0.94 |
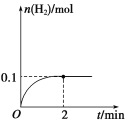
�ٰ�������立ֽ�Ļ�ѧ����ʽΪ![]() ����25.0��ʱ�ﵽƽ������ʱ��Ϊ8min���������ݼ���
����25.0��ʱ�ﵽƽ������ʱ��Ϊ8min���������ݼ���![]() ��ƽ����������Ϊ________________��
��ƽ����������Ϊ________________��
�ڿ����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����_________��
A.2����NH3����=�ԣ�CO2���� B.�ܱ���������ѹǿ����
C. �ܱ������л��������ܶȲ��� D. �ܱ������а����������������