题目内容
【题目】按要求回答下列问题
(1)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) H=-1275.6kJ·mol-1
②H2O(l)=H2O(g) H=+44.0 kJ·mol-1 写出表示甲醇燃烧热的热化学方程式___________________________。
(2)已知:CH3OH(g)+ ![]() O2(g)
O2(g)![]() CO2(g)+2H2(g) H1=-192.9kJ·mol-1
CO2(g)+2H2(g) H1=-192.9kJ·mol-1
H2(g)+ ![]() O2 (g)
O2 (g) ![]() H2O(g) H2=-120.9kJ·mol-1
H2O(g) H2=-120.9kJ·mol-1
则甲醇与水蒸气催化重整反应的焓变H3________________。
(3)苯乙烯是重要的基础有机原料。工业中用乙苯(C6H5—CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH=CH2)的反应方程式为:C6H5—CH2CH3(g)![]() C6H5—CH=CH2(g)+H2(g) H1
C6H5—CH=CH2(g)+H2(g) H1
已知:3C2H2(g)![]() C6H6(g) H2;C6H6(g)+C2H4(g)
C6H6(g) H2;C6H6(g)+C2H4(g)![]() C6H5—CH2CH3(g) H3
C6H5—CH2CH3(g) H3
则反应3C2H2(g)+C2H4(g)![]() C6H5—CH=CH2(g) +H2(g)的H =________。
C6H5—CH=CH2(g) +H2(g)的H =________。
(4)氨的合成是最重要的化工生产之一。工业上合成氨用的H2有多种制取的方法:
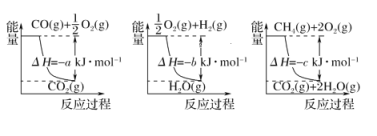
①用焦炭跟水反应: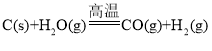 ;
;
②用天然气跟水蒸气反应: 已知有关反应的能量变化如图所示,则方法②中反应的H =________。
已知有关反应的能量变化如图所示,则方法②中反应的H =________。
【答案】CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)ΔΗ=-725.8 kJ·mol-1 -72.0 kJ·mol-1 ΔΗ1+ΔΗ2+ΔΗ3 (a+3b-c)kJ·mol-1
O2(g)=CO2(g)+2H2O(l)ΔΗ=-725.8 kJ·mol-1 -72.0 kJ·mol-1 ΔΗ1+ΔΗ2+ΔΗ3 (a+3b-c)kJ·mol-1
【解析】
(1)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔΗ=-1 275.6 kJ·mol-1;
②H2O(l)=H2O(g) ΔΗ=+44.0 kJ·mol-1,根据盖斯定律,①×![]() -②×2得CH3OH(l)+
-②×2得CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔΗ=-725.8 kJ·mol-1;
O2(g)=CO2(g)+2H2O(l) ΔΗ=-725.8 kJ·mol-1;
答案:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔΗ=-725.8 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔΗ=-725.8 kJ·mol-1
(2)根据盖斯定律和已知方程式,可得甲醇和水蒸气催化重整的方程式=①-②,所以焓变ΔΗ3=ΔΗ1-ΔΗ2= -192.9kJ/mol +120.9kJ/mol=-72.0kJ/mol;
答案:-72.0 kJ·mol-1
(3)根据盖斯定律,将已知三个热化学方程式相加即得所求方程式,所求热效应也等于三式的热效应相加,所以ΔΗ=ΔΗ1+ΔΗ2+ΔΗ3;
答案:ΔΗ1+ΔΗ2+ΔΗ3
(4)由图知CO(g)+![]() O2(g)=CO2(g)ΔΗ=-akJ/mol;①
O2(g)=CO2(g)ΔΗ=-akJ/mol;①
H2(g)+![]() O2(g)= H2O(g)ΔΗ=-bkJ/mol;②
O2(g)= H2O(g)ΔΗ=-bkJ/mol;②
CH4(g)+2O2(g)= 2H2O(g)+ CO2(g)ΔΗ=-ckJ/mol③
根据盖斯定律得方法②中反应的ΔΗ=③-①-②×3=-c-(-a)-(-b) ×3=(a+3b-c)kJ/mol;
答案:(a+3b-c)kJ·mol-1

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】某研究小组探究氨基甲酸铵(![]() )分解的化学平衡和水解反应速率。将一定量纯净的氨基甲酸铵置于固定容积为100mL的密闭真空溶液A中,在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
)分解的化学平衡和水解反应速率。将一定量纯净的氨基甲酸铵置于固定容积为100mL的密闭真空溶液A中,在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总物质的量(mol) | 0.34 | 0.48 | 0.68 | 0.94 |
①氨基甲酸铵分解的化学方程式为![]() ,若25.0℃时达到平衡所用时间为8min,根据数据计算
,若25.0℃时达到平衡所用时间为8min,根据数据计算![]() 的平均生成速率为________________。
的平均生成速率为________________。
②可以判断该分解反应已经达到化学平衡的是_________。
A.2υ(NH3)正=υ(CO2)逆 B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
【题目】“绿水青山就是金山银山”,因此研究NOx,SO2等大气污染物的妥善处理具有重要意义。
SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=akJ/mo1;
②NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) △H2=b kJ/mo1;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJ/mo1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O △H
(1)△H =______kJ/mo1 (用含a、b、c的代数式表示)。
(2)对于反应:C(s)+2NO(g)![]() N2(g)+CO2(g) △H =-34.0kJ/mol,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
N2(g)+CO2(g) △H =-34.0kJ/mol,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,CO2的平均反应速度v(CO2)=________。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是_______(填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
(3)用活性炭还原法处理NO,有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g) △H =-34.0kJ/mo1。已知在一体积不变的密闭容器中,加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如下图所示:
N2(g)+CO2(g) △H =-34.0kJ/mo1。已知在一体积不变的密闭容器中,加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如下图所示:

①由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________;
②在1100K时,CO2的体积分数为________。
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H =-746.8 kJ/mo1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H =-746.8 kJ/mo1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”) k逆增大的倍数。
②若在2L的密闭容器中充入2molCO和2molNO,在一定温度下达到平衡时,CO的转化率为50%,则![]() _______。
_______。