��Ŀ����
����Ŀ����1��50 mL 0.50 mol/L������50 mL 0.55 mol/L NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
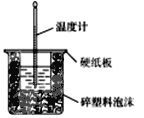
�ٴ�ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��______��
�ڴ��ձ����粻��Ӳֽ�壬��õ��к�����ֵ��________ (���� ƫ������ƫС��������Ӱ����)��
��2������к͵ζ�����ѧ��ѧ����ʵ�顣
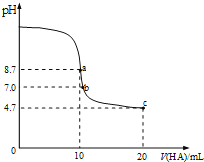
ijѧУ��ѧ����С����0.2000 mol��L-1����ζ�δ֪Ũ�ȵ�����������Һ���Իش��������⡣
�ٵζ������У��۾�Ӧע��_____________________________________��
��������̨�ϵ�һ�Ű�ֽ����Ŀ����_____________________________��
�۸����±����ݣ����㱻���ռ���Һ�����ʵ���Ũ����____mol��L��1����������λ��Ч���֣�
������ʵ������Եζ��������ʲôӰ��(����ƫ��������ƫ����������Ӱ����)?
a.�۲���ʽ�ζ���Һ��ʱ����ʼ���ӣ��ζ��յ�ƽ�ӣ���ζ����________��
b.������ƿ�ô���Һ��ϴ��Ȼ���ټ���10.00 mL����Һ����ζ����_______��
���𰸡����β�������� ƫС ��ƿ����Һ��ɫ�ı仯 ���ڹ۲���ƿ��Һ����ɫ�ı仯����С�ζ���� 0.4000 ƫ�� ƫ��
��������
��1����ʵ������Ҫ���裬���Դ�ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ�ǻ��β����������
�ڴ��ձ����粻��Ӳֽ�壬��������������ʧ������õ��к�����ֵ��ƫС��
��2���ٵζ������У��۾�Ӧע����ƿ����Һ��ɫ�ı仯��
��������̨�ϵ�һ�Ű�ֽ����Ŀ���DZ��ڹ۲���ƿ��Һ����ɫ�ı仯����С�ζ���
�۸��ݱ��е����ݿ�֪������ʵ������������������20.10ml��19.90ml�����������������ƽ��ֵ��20.00ml�������ռ���Һ��Ũ����![]() ��0.4000mol/L��
��0.4000mol/L��
�ܹ۲���ʽ�ζ���Һ��ʱ����ʼ���ӣ��ζ��յ�ƽ�ӡ����ڸ��Ӷ���ƫС��������ζ����ƫ�ߣ�������ƿ�ô���Һ��ϴ��Ȼ���ټ���10.00 mL����Һ�������������������ӣ����Եζ����ƫ�ߡ�

 ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д� �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
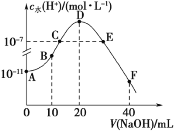
���⿼����Ԫ���Ծ�ϵ�д�����Ŀ��һ���¶��£��� 2.0 L�����ܱ������г���1.0 mol PCl5����ӦPCl5(g)PCl3(g)��Cl2(g)����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ���ǣ� ��
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.��Ӧ��ǰ 50 s ��ƽ������v(PCl3)��0.0032 mol��L1��s1
B.�������£���Ӧ��ƽ�ⳣ��K=0.05
C.���������������䣬�����¶ȣ�ƽ��ʱc(PCl3)��0.11 mol��L1����Ӧ����H��0
D.����������ͬʱ����յ������г���1.0 mol PCl5��0.20 mol PCl3��0.20 mol Cl2����ʱ v(��)��v(��)
����Ŀ��Ϊ̽��Na2SO3 ��Һ��(VI)����Һ�ķ�Ӧ���ɣ�ijС��ͬѧ����ʵ�����£� ��֪��![]() (��ɫ)+ H2O
(��ɫ)+ H2O![]() (��ɫ)+ 2H+
(��ɫ)+ 2H+
(1)������Һ
��� | ���� | ���� |
i | ���Ʊ���Na2SO3 ��Һ������Һ��pH | pH ԼΪ 9 |
ii | ����0.05 mol��L1 ��K2Cr2O7��Һ������Һƽ���ֳ����ݣ���������Һ�зֱ�μ�Ũ�����Ũ KOH ��Һ���õ�pH=2 ����ҺA �� pH=8 ����ҺB | pH=2����ҺA �ʳ�ɫ��pH=8����Һ B �ʻ�ɫ |
�� �û�ѧ�����ʾ���� Na2SO3 ��Һ pH ԼΪ 9 ��ԭ��__��
(2)����ʵ��iii �� iv��
��� | ���� | ���� |
iii | �� 2 mL ��Һ A �еμ� 3 �α��� Na2SO3 ��Һ | ��Һ����ɫ(��Cr3+) |
iv | �� 2 mL ��Һ B �еμ� 3 �α��� Na2SO3 ��Һ | ��Һû�����Ա仯 |
�� �����ӷ���ʽ���� iii ������__��
(3)��������ʵ��v��
��� | ���� | ���� |
v | �� 2 mL ���� Na2SO3 ��Һ�еμ� 3 ����ҺA | ��Һ���ɫ |
vi | �� 2 mL ����ˮ�еμ� 3 ����ҺA | ��Һ��dz��ɫ |
�� ʵ�� vi ��Ŀ����__��
�� �û�ѧƽ���ƶ�ԭ������ v ������__��
�� ����ʵ��iii��v�����Ʋ⣺Na2SO3 ��Һ��(VI)����Һ�ķ�Ӧ����Һ������йأ�__��
�� ��ʵ�� v ���û�ɫ��Һ�еμ�__������������֤ʵ�������Ʋ⡣
(4)����̽����Һ������ǿ�Ը�(VI)����Һ�����Ե�Ӱ�죬��ͬѧ������ͼװ�ü���ʵ��(��֪��ѹ��С��ӳ������������ԭ��ǿ���IJ��죻�����������뻹ԭ��ǿ������Խ��ѹԽ��)��
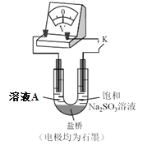
a.K �պ�ʱ����ѹΪa��
b.��U �������Һ�еμ� 3 ��Ũ�����ѹ������b��
�� ����ʵ��˵����__��
�� ��ͬѧ��Ϊ������Һ������ǿ����Һ��O2 ����������ǿҲ��ʹ��ѹ����������ͼװ��ѡ������Լ�����ʵ�飬�������O2 �Ĵ��ڲ�Ӱ���������ۡ���ʵ�鷽����__����õ�ѹ������ d(d < b)��