题目内容
17.常温下,将1.92g铜加入到100mL H2SO4和HNO3的混合液中,Cu恰好全部溶解,假设只放出NO气体,再向溶液中加入铜粉,不放出气体.(1)标准状况下放出NO气体的体积是4.48L;
(2)原溶液中H2SO4的浓度至少应为2mol/L.
分析 (1)发生反应3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O,n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,结合电子守恒计算NO的物质的量,再由V=nVm计算其体积;
(2)结合n(H+)=2n(H2SO4)+n(HNO3)、c=$\frac{n}{V}$计算.
解答 解:(1)n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,由电子守恒可知,n(NO)=$\frac{0.3mol×(2-0)}{(5-2)}$=0.2mol,标准状况下放出NO气体的体积是0.2mol×22.4L/mol=4.48L,
故答案为:4.48;
(2)由3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O可知,0.3molCu恰好溶解需要0.8molH+,
n(NO)=n(HNO3),n(H+)=2n(H2SO4)+n(HNO3),
则n(H2SO4)=$\frac{0.8mol-0.2mol}{2}$=0.2mol,
所以原溶液中H2SO4的浓度至少应为$\frac{0.2mol}{0.1L}$=2mol/L,
故答案为:2.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、电子守恒及原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
18.下列有机物中,哪一种不可能是醇脱氢直接生成的是:( )
| A. | 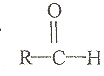 | B. |  | C. | 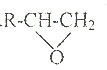 | D. | 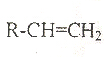 |
8.下列图片与其相关描述正确的共有( )
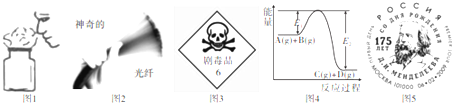
①图1为闻气体时的正确操作
②图2为单质硅的用途之一
③图3为浓硫酸的罐车上所贴的危险化学品标识
④图4反应A(g)+B(g)=C(g)+D(g)为吸热反应
⑤图5为按元素相对原子质量制出第一张元素周期表的俄国化学家门捷列夫纪念币.

①图1为闻气体时的正确操作
②图2为单质硅的用途之一
③图3为浓硫酸的罐车上所贴的危险化学品标识
④图4反应A(g)+B(g)=C(g)+D(g)为吸热反应
⑤图5为按元素相对原子质量制出第一张元素周期表的俄国化学家门捷列夫纪念币.
| A. | 1组 | B. | 2组 | C. | 3组 | D. | 4组 |
5.下列各种冶炼方法中,可制得相应金属的是( )
| A. | 加热Al2O3 | B. | 加热CaCO3 | ||
| C. | 电解熔融NaCl | D. | 氰化钠与铝粉高温共热 |
2.下列说法中正确的是( )
| A. | 因为p轨道是“8”字形的,所以p的电子走“8”字形 | |
| B. | K能级有3s,3p,3d,3f四个轨道 | |
| C. | 氢原子只有一个电子,故氢原子只有一个轨道 | |
| D. | 以上说法均不正确 |
9.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mo1•L-1 | |
| B. | 标准状况下,22.4L水所含的分子数为NA | |
| C. | 常温常压下NO2和N2O4混合气体22.4L,其中含有的原子总数为0.3NA | |
| D. | 常温下,4gCH4含有NA个C-H共价键 |
6.2NO2(g)?N2O4(g)达到平衡后下列条件的改变可使NO2气体浓度增大的是( )
| A. | 增大容器的容积 | B. | 再充入一定量的N2O4 | ||
| C. | 分离出一定量的NO2 | D. | 再充入一定量的He |
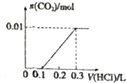 短周期主族元素A、B、C、D、E、F的原子序数依次增大,已知A的原子半径比B的小,B在反应中既不容易得到电子也不容易失去电子,C元素的气态氢化物和其最高价氧化物对应水化物能化合生成盐,元素D的原子最外层电子数是其电子层数的3倍,E与A同一主族,F常用于制半导体.
短周期主族元素A、B、C、D、E、F的原子序数依次增大,已知A的原子半径比B的小,B在反应中既不容易得到电子也不容易失去电子,C元素的气态氢化物和其最高价氧化物对应水化物能化合生成盐,元素D的原子最外层电子数是其电子层数的3倍,E与A同一主族,F常用于制半导体.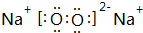
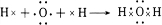 ,写出A2D与X反应的化学方程式,并用单线桥标出电子转移
,写出A2D与X反应的化学方程式,并用单线桥标出电子转移