题目内容
7.由两种短周期元素组成的化合物,其中两种元素的原子个数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是( )①a=b+4;②a+b=8; ③a+b=30; ④a=b+8.
| A. | ①②③④ | B. | ①③④ | C. | ②④ | D. | ③④ |
分析 两种短周期元素组成的化合物中原子数比为1:3,则化学式为AB3型,可能为第ⅢA族与ⅥⅠA组元素组成、可能为第ⅤA族和ⅥⅠA族元素组成、还可能为NH3或SO3,注意C2H6中原子数比为1:3,然后分析原子序数的关系.
解答 解:两种短周期元素组成的化合物中原子数比为1:3,则化学式为AB3型,
两种元素的原子序数分别是a和b,
若为AlF 3,则13=9+4,故①可能;
若为NH3,则7+1=8,故②可能;
若为AlCl3,则13+17=30,故③可能;
若为SO3,则16=8+8,故④可能;
显然①②③④都可能,
故选A.
点评 本题考查化合物中原子序数的关系,题目难度不大,明确常见的AB3型的化合物是解答本题的关键,本题中C2H6为学生思考容易遗漏的问题.

练习册系列答案
相关题目
18.下列热化学方程式正确的是( )
| A. | 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知在120℃,101kPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ•mol-1 | |
| D. | 25℃,101Kpa时,强酸与强碱的稀溶液发生反应的中和热为57.3kJ•mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式可表示为:H2SO4(aq)+2KOH(aq)═K2SO4(aq)+2H2O(1)△H=-114.6kJ•mol-1 |
15.实验室中关于物质的保存方法,错误的是( )
| A. | 氯水保存在棕色瓶中,冷暗处放置 | B. | 漂白粉可以敞口放置在空气中 | ||
| C. | 液氯可以保存在干燥的钢瓶中 | D. | Na在盛煤油的试剂瓶中密封保存 |
12.将4.6gN2O4晶体放入容积为2L的容器中,升温到25℃,N2O4完全汽化并发生反应:N2O4?2NO2,反应达到平衡后,同温下测得压强为N2O4,完全汽化而未发生反应时压强的1.2倍,则下列不正确的是( )
| A. | 若升高温度,气体颜色将变深 | |
| B. | 平衡时NO2和N2O4的物质的量之比为1:2 | |
| C. | 平衡时混合气体的平均相对分子质量约为76.7 | |
| D. | 若相同温度下的另一容器中N2O4浓度为0.03mol/L,NO2浓度为0.01mol/L时,反应速率的关系为v正<v逆 |
19.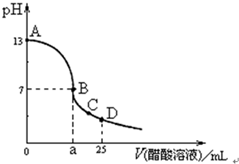 在25mL 0.1mol?L-1 NaOH溶液中逐滴加入0.2mol?L-1 CH3COOH溶液,曲线如图所示,下列判断正确的是( )
在25mL 0.1mol?L-1 NaOH溶液中逐滴加入0.2mol?L-1 CH3COOH溶液,曲线如图所示,下列判断正确的是( )
 在25mL 0.1mol?L-1 NaOH溶液中逐滴加入0.2mol?L-1 CH3COOH溶液,曲线如图所示,下列判断正确的是( )
在25mL 0.1mol?L-1 NaOH溶液中逐滴加入0.2mol?L-1 CH3COOH溶液,曲线如图所示,下列判断正确的是( )| A. | B点,a=12.5 | |
| B. | D点,c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 在A、B间存在一点,此点水的电离程度最大 | |
| D. | 在C点升温,CH3COOH电离程度增大,CH3COO-的水解程度减小 |
16.某元素一种同位素原子的质子数为m,中子数为n,则下述论断正确的是( )
| A. | 这种元素的相对原子质量为m+n | |
| B. | 不能由此确定该元素的相对原子质量 | |
| C. | 若碳原子质量为Wg,此原子的质量为(m+n)Wg | |
| D. | 核内中子的总质量小于质子的总质量 |
17.标准状况下22.4LCO气体在足量氧气中燃烧后,加足量的过氧化钠充分吸收气体后,过氧化钠质量增加了( )
| A. | 28g | B. | 4.4g | C. | 10.6g | D. | 1.4g |