题目内容
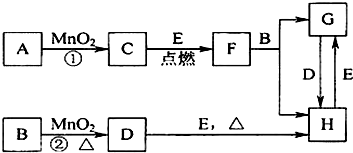
6.将0.15mol的MnO2与过量的12mol/L的浓盐酸反应,与50mL12mol/L的浓盐酸与过量MnO2反应,两者产生的氯气相比(其它反应条件相同)( )| A. | 一样多 | B. | 后者较前者多 | C. | 前者较后者多 | D. | 无法比较 |
分析 发生MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O,浓盐酸随浓度变稀后不能和二氧化锰发生反应,以此来解答.
解答 解:过量的12mol/L的浓盐酸反应可保证二氧化锰完全反应,
而后者,随反应的进行,浓盐酸变为稀盐酸,不能反应生成氯气,则生成的氯气比前者少,
故选C.
点评 本题考查氧化还原反应,为高频考点,把握发生的氧化还原反应的特点为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
16.一定温度下,将2mol SO2和1mol O2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-1,当达到平衡状态时,下列说法中正确的是( )
| A. | 生成2molSO3 | |
| B. | SO2和SO3物质的量之和一定为2mol | |
| C. | 放出197kJ的热量 | |
| D. | 平衡时容器内气体压强和开始时压强相等 |
11.下列实验操作中有错误的是( )
| A. | 蒸馏操作时,应使温度计水银球置于混合液中 | |
| B. | 蒸馏操作时,冷却水应从冷凝管的下口通入,上口流出 | |
| C. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,再停止加热 |


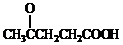 )合成聚芳酯E的路线:
)合成聚芳酯E的路线: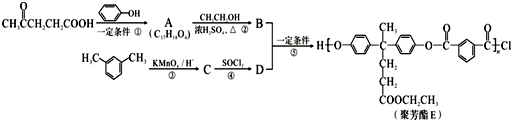
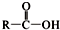 +SOCl2→
+SOCl2→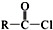 +SO2+HCl
+SO2+HCl +R′OH→
+R′OH→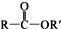 +HCl (R、R′表示烃基)
+HCl (R、R′表示烃基)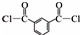 .
.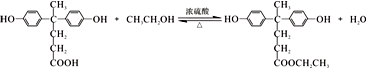 .
. 结构
结构 .
.