题目内容
16.一定温度下,将2mol SO2和1mol O2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-1,当达到平衡状态时,下列说法中正确的是( )| A. | 生成2molSO3 | |
| B. | SO2和SO3物质的量之和一定为2mol | |
| C. | 放出197kJ的热量 | |
| D. | 平衡时容器内气体压强和开始时压强相等 |
分析 A、对于可逆反应,反应物不可能完全转化为生成物;
B、根据硫原子守恒进行判断SO3和SO2 物质的量之和;
C、根据热化学方程式的反应热意义及可逆反应特点判断;
D、根据化学平衡状态的特点进行分析.
解答 解:A、该反应为可逆反应,1mol氧气完全反应才能生成2mol二氧化硫,由于可逆反应不可能完全转化成生成物,所以生成的三氧化硫的物质的量小于2mol,故A错误;
B、根据质量守恒,含有硫原子的物质只有二氧化硫和三氧化硫,反应前有2mol二氧化硫,所以SO3和SO2 物质的量之和一定为2mol,故B正确;
C、热化学方程式中:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,反应消耗1mol氧气能够放出197kJ热量,由于可能反应中反应物转化率不可能是100%,所以反应中放出的热量小于197kJ,故C错误;
D、反应是气体体积减小的反应,达到平衡状态,物质的量一定不相等,平衡时容器内气体压强和开始时压强不相等,故D错误;
故选B.
点评 本题考查了可逆反应特点、化学平衡状态的判断,题目难度中等,注意掌握可逆反应中反应物不可能完全转化成生成物,明确判断化学平衡状态的方法,试题有利于提高学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
9.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )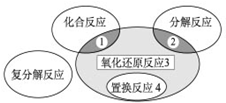

| A. | 2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | CuO+CO $\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | D. | Zn+H2SO4═ZnSO4+H2↑ |
10.${\;}_1^1H、$${\;}_1^2H、$${\;}_1^3H、$H+、H2,下列说法正确的是( )
| A. | 具有相同的质子数 | B. | 具有不同的电子数 | ||
| C. | 这些微粒互称同位素 | D. | 它们是氢元素不同的五种微粒 |
1.1gN2含a个分子,则阿伏加德罗常数可表示为( )
| A. | a/28mol-1 | B. | a mol-1 | C. | 28a mol-1 | D. | a/14 mol-1 |
5.向下列物质的浓溶液中缓慢地通入过量CO2气体,整个过程中无明显现象的是( )
| A. | 水玻璃 | B. | 澄清石灰水 | C. | 氯化钙 | D. | 饱和碳酸钠 |
6.将0.15mol的MnO2与过量的12mol/L的浓盐酸反应,与50mL12mol/L的浓盐酸与过量MnO2反应,两者产生的氯气相比(其它反应条件相同)( )
| A. | 一样多 | B. | 后者较前者多 | C. | 前者较后者多 | D. | 无法比较 |
