题目内容
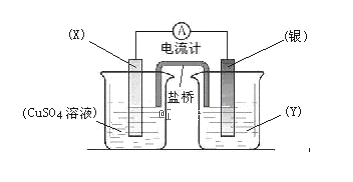
【题目】Ⅰ、根据氧化还原反应:2Ag+(aq)+ Cu(s) = Cu2+(aq)+ 2Ag(s) 设计的原电池如下图所示,其中盐桥为琼脂–饱和KNO3盐桥。请回答下列问题:
(1)电极X的材料是 ___________;电解质溶液Y是 ____________________。
(2)银电极为电池的 __________ 极,其电极反应式为:___________________________________ 。
(3)盐桥中向CuSO4溶液中迁移的离子是 ___________。

A、K+ B、NO3― C、Ag+ D、SO42―
Ⅱ、酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料。回答下列问题:
(1)该电池的正极反应式为 ________________________,电池反应的离子方程式为________________________________________
(2)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过 ___________________________________ 分离回收。
(3)滤渣的主要成分是MnO2、碳粉和MnOOH,欲从中得到较纯的MnO2,最简便的方法是_________________________________________。
【答案】Cu AgNO3溶液 正极 2Ag++2e-=2Ag B MnO2+H++e-=MnOOH 2MnO2+Zn+2H+=2MnOOH+Zn2+ 加热浓缩;冷却结晶 在足量的空气或氧气中加热
【解析】
Ⅰ、由反应方程式可知,该原电池的电极反应式为:正极:2Ag++2e-═2Ag,负极:Cu-2e-═Cu2+,所以X极的材料应为Cu,电解质溶液Y应为AgNO3溶液,外电路中的电子从Cu极流向Ag极。盐桥中的K+移向正极(Ag极);NO3-移向负极(Cu极),以此解答;
Ⅱ、(1)该电池的正极发生还原反应,MnO2被还原生成MnOOH;
(2)滤液中主要有ZnCl2和NH4Cl,根据溶解度的差异,可通过加热浓缩溶液;
(3)在空气中加热时,碳粉、MnOOH可被氧化,分别生成二氧化碳和二氧化锰。
Ⅰ、(1)硫酸铜溶液所在的电极是负极,所以电极X的材料是Cu;银电极是正极,则电解质溶液Y是AgNO3溶液;
(2)银离子得到电子,银电极为电池的正极,发生的电极反应式为2Ag++2e-=2Ag;
(3)原电池工作时,阴离子向负极移动,阳离子向正极移动,盐桥中向CuSO4溶液中迁移的离子应是阴离子,应为NO3-;
故答案为:B;
Ⅱ、(1)该电池的正极发生还原反应,MnO2被还原生成MnOOH,电极方程式为MnO2+H++e-=MnOOH,负极锌被氧化生成Zn2+,电池总反应式为2MnO2+Zn+2H+=2MnOOH+Zn2+;
(2)滤液中主要有ZnCl2和NH4Cl,根据溶解度的差异,可通过加热浓缩溶液,到一定程度NH4Cl析出,而ZnCl2保留在水中,达到分离的目的;
答案为:加热浓缩;冷却结晶;
(3)填充物含有碳粉、二氧化锰,且生成MnOOH等,在空气中加热时,碳粉、MnOOH可被氧化,分别生成二氧化碳和二氧化锰;
答案为:在足量的空气或氧气中加热。