题目内容
15.如图为反应X+Y?M的能力随反应历程变化的示意图,下列叙述中正确的是( )
| A. | X的能量一定高于M | B. | 正反应为吸热反应 | ||
| C. | 该反应一定要加热后才能发生 | D. | 反应物总能量高于生成物总能量 |
分析 根据图象可知,反应物的总能量小于生成物的总能量,可知反应吸热,正反应为吸热反应则逆反应为放热反应,据此解答.
解答 解:根据图象可知,反应物的总能量小于生成物的总能量,可知反应吸热,正反应为吸热反应则逆反应为放热反应,
A、从图上可知,X和Y具有的总能量小于M具有的总能量,不能判断X和M的能量关系,故A错误;
B、根据图象可知,反应物的总能量小于生成物的总能量,可知反应吸热,故B正确;
C、吸放热反应与反应条件无关,故C错误;
D、从图上可知,反应物具有的总能量小于生成物具有的总能量,故D错误;
故选:B.
点评 本题考查吸热反应的图象分析,注意正逆反应的焓变是相反数、焓变是反应物能量和与生成物能量和的差值,题目难度不大.

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
3.只用一种试剂,区别甲苯、四氯化碳、已烯、水四种无色液体,应选用( )
| A. | 酸性KMnO4溶液 | B. | 溴水 | C. | 乙醇 | D. | 硝酸银溶液 |
10.下列物质中既有离子键、又有共价键的是( )
| A. | C60 | B. | CaCl2 | C. | KF | D. | NH4Cl |
7.下列说法中正确的是( )
| A. | 分子组成中相差一个或几个CH2 原子团的有机物是同系物 | |
| B. | 各组成元素质量分数相同的烃是同一种烃 | |
| C. | 分子式相同而结构不同的有机物不一定是同分异构体 | |
| D. | 互为同系物的有机物其分子结构必然相似 |
4.已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构.下列关于X、Y、Z、W四种元素的描述,正确的是( )
| A. | 原子半径:X>Y>Z>W | B. | 金属性:X<Y,还原性:W 2->Z- | ||
| C. | 原子最外层电子数:Y>X>Z>W | D. | 原子序数:Y>X>Z>W |
5.下列离子方程式书写不正确的是( )
| A. | 少量铁粉加入稀盐酸中:Fe+2H+=Fe2++H2↑ | |
| B. | Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| C. | NH4HCO3溶液和过量Ba(OH)2溶液共热:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O | |
| D. | 重铬酸钾溶液中:Cr2O72-+H2O?2CrO42-+2H+ |
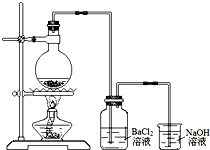 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按右图所示装置进行实验. A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).
A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出).