题目内容
12.某厂以重晶石(有效成分是BaSO4)为主要原料制取Ba(OH)2•8H2O晶体的示意图如下:
已知:i.BaSO4(s)+2C(s)═2CO2(g)+BaS(s)△H1=+226.2kJ/mol
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
ii.某些物质的溶解度(g/100gH2O)简表
| 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | |
| Ba(OH)2•8H2O | 2.48 | 3.89 | 8.22 | 20.9 | 101 |
| NaOH | 98.0 | 109 | 129 | 174 | 314 |
| NaCl | 35.8 | 35.9 | 36.4 | 37.1 | 38.0 |
| BaCl2 | 33.5 | 35.8 | 40.8 | 46.2 | 52.5 |
(1)炭与重晶石直接反应的热化学方程式是:BaSO4(s)+4C(s)═BaS(s)+4CO(g)△H=+571.2kJ/mol.
(2)由BaCl2溶液可通过不同途径得到Ba(OH)2•8H2O.
途径1:BaCl2溶液$→_{过滤}^{Na_{2}CO_{3}固体}$固体1$\stackrel{灼烧}{→}$固体2$\stackrel{H_{2}O}{→}$Ba(OH)3.8H2O
①得到固体1的离子方程式是CO32-+Ba2+=BaCO3↓.
②固体2与水反应的化学方程式是BaO+9H2O=Ba(OH)2•8H2O.
途径2:BaCl2溶液$→_{操作}^{NaOH溶液}$Ba(OH)3.8H2O
途径2中的“操作”是加热浓缩,冷却结晶,过滤.依据上述溶解度简表分析,过滤时的最佳温度是20℃或常温;能从混合液中得到Ba(OH)2•8H2O晶体的原因是20℃时4种物质中Ba(OH)2•8H2O溶解度最小.
(3)若向滤液1中加入CuO粉末,可直接得到含Ba(OH)2•8H2O晶体和CuS的浊液,反应化学方程式是BaS+CuO+9H2O=Ba(OH)2•8H2O+CuS.将该浊液加热到80℃左右浓缩,趁热过滤,冷却滤液至室温,再过滤,即可得到Ba(OH)2•8H2O晶体.上述操作中趁热过滤的原因是减少过滤过程中Ba(OH)2•8H2O的损失.
分析 碳和重晶石精选矿砂焙烧生成气体一氧化碳和二氧化碳,烧渣水浸过滤得到滤液Ⅰ,加盐酸反应得到氯化钡溶液,加入试剂得到氢氧化钡晶体,
(1)①BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H1=+226.2 kJ/mol
②C(s)+CO2(g)=2CO(g)△H2=+172.5kJ/mol,
则由盖斯定律可知①+②×4得到BaSO4(s)+4C(s)=BaS(s)+4CO(g);
(2)途径1中氯化钡与碳酸钠反应生成碳酸钡沉淀,碳酸钡灼烧生成BaO,与水反应生成Ba(OH)2•8H2O;
途径2中,由溶解性表可知,较低温度时Ba(OH)2•8H2O易析出,且四种物质中相同温度时Ba(OH)2•8H2O的溶解度最小易得到;
(3)滤液1中加入CuO粉末,可直接得到含Ba(OH)2•8H2O晶体和CuS的浊液,则由反应物与生成物书写化学反应;该浊液加热到80℃左右浓缩,趁热过滤,减少晶体的损失.
解答 解:(1)①BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H1=+226.2 kJ/mol
②C(s)+CO2(g)=2CO(g)△H2=+172.5kJ/mol,
则由盖斯定律可知①+②×4得到BaSO4(s)+4C(s)=BaS(s)+4CO(g),
△H=+226.2 kJ/mol+4×(+172.5kJ/mol)=+571.2kJ/mol,
故答案为:+571.2;
(2)途径1中氯化钡与碳酸钠反应生成碳酸钡沉淀,则得到固体1的离子方程式是CO32-+Ba2+=BaCO3↓,碳酸钡灼烧生成BaO,与水反应生成Ba(OH)2•8H2O,则固体2与水反应的化学方程式是BaO+9H2O=Ba(OH)2•8H2O;
途径2中,由溶解性表可知,较低温度时Ba(OH)2•8H2O易析出,且四种物质中相同温度时Ba(OH)2•8H2O的溶解度最小易得到,则过滤时的最佳温度是20℃或常温,因20℃时4种物质中Ba(OH)2•8H2O溶解度最小,
故答案为:CO32-+Ba2+=BaCO3↓;BaO+9H2O=Ba(OH)2•8H2O;20℃或常温;20℃时4种物质中Ba(OH)2•8H2O溶解度最小;
(3)滤液1中加入CuO粉末,可直接得到含Ba(OH)2•8H2O晶体和CuS的浊液,反应为BaS+CuO+9H2O=Ba(OH)2•8H2O+CuS,趁热过滤的原因是为减少过滤过程中Ba(OH)2•8H2O的损失,
故答案为:BaS+CuO+9H2O=Ba(OH)2•8H2O+CuS;减少过滤过程中Ba(OH)2•8H2O的损失.
点评 本题考查物质分离提纯方法和综合应用,为高频考点,把握物质的性质、表格数据分析及混合物分离方法和原理为解答的关键,侧重分析与实验能力的考查,题目难度中等.

 发散思维新课堂系列答案
发散思维新课堂系列答案CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2↑+H2O
CH2═CH2+Br2-→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚,用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
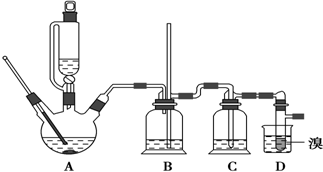
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母).
a.引发反应 b.加快反应速度c.防止乙醇挥发 d减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母).
a.水 b.浓硫酸c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”).
(5)若产物中有少量未反应的Br2,最好用b洗涤除去.(填正确选项前的字母)
a.水 b.氢氧化钠溶液c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.
S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
实验室制备S2Cl2的反应原理有两种:
①CS2+3C12$\frac{\underline{\;95~100℃\;}}{\;}$ CC14+S2Cl2;
②2S+Cl2$\frac{\underline{\;111~140℃\;}}{\;}$ S2Cl2.
(1)若实验室选择图装置(部分夹持装置已略去)来制备S2Cl2,其反应原理是上述中的①(填写序号);图中尾气处理装置不够完善,改进后的装置应起到的作用是:在D和E之间增加装置以起到干燥、尾气吸收、防倒吸的作用.利用改进后的正确装置进行实验,请回答以下问题:
(2)为了提高产品S2Cl2的纯度,实验操作的关键是控制好温度和控制浓盐酸的滴速不要太快.
(3)该实验的操作顺序为:①③②⑤④(用序号表示).
①点燃酒精灯A ②点燃酒精灯D ③通冷凝水 ④熄灭酒精灯A ⑤熄灭酒精灯D
(4)某同学取少量产物,小心加入适量水中,观察到有白雾、黄色沉淀且产生的无色气体能使品红溶液褪色,该同学据此判断上述实验确有S2Cl2生成.写出S2Cl2与水反应的化学方程式:2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
(5)S2Cl2中每个原子的最外层都具有8电子结构,请用电子式表示S2Cl2的形成过程:
 .
. | A. | 常温下锌与浓硫酸不反应,与稀硫酸反应生成氢气 | |
| B. | 加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+ | |
| C. | 向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色 | |
| D. | FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体剩余,加入KCSN溶液变成血红色 |
 ).请用化学方程式表示其制备过程.
).请用化学方程式表示其制备过程.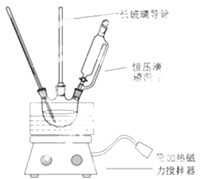 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的组装如图反应装置,过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的组装如图反应装置,过程如下: .
.
 常温下,10mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示:请回答下列问题:
常温下,10mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示:请回答下列问题: