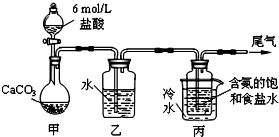
题目内容
3. 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的组装如图反应装置,过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的组装如图反应装置,过程如下:步骤:取100mL烧杯,用20mL浓硫酸与浓硝酸18mL配制混和酸,加入恒压漏斗中.把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50-60℃下发生反应,直至反应结束.
④将反应后的液体依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
请回答下列问题:
(1)配置混酸应先在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后产品在液体的下层(填“上”或者“下”),分离混酸和产品的操作方法为分液.
(5)为了得到更纯净的硝基苯,还须先向液体中加入氯化钙除去水,然后蒸馏.
(6)写出制备硝基苯的化学方程式
 .
.
分析 取100mL烧杯,用20mL浓硫酸与浓硝酸18mL配制混和酸,加入恒压漏斗中.把18mL苯加入三颈烧瓶中,向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀,在50-60℃下发生反应,直至反应结束,将反应后的液体依次用蒸馏水和10% Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品,
(1)将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌,如果将浓硝酸加到浓硫酸中可能发生液体飞溅的情况;
(2)恒压滴液漏斗代替分液漏斗可以平衡内外压强,使氨水顺利滴下;
(3)苯、浓硝酸沸点低,易挥发,长玻璃管能冷凝回流挥发的苯、浓硝酸,据此选择替代仪器;
(4)具有苦杏仁味的硝基苯的密度比水大,分离互不相溶的液态,采取分液操作;
(5)要得到纯净的硝基苯,粗产品依次用蒸馏水、10%Na2CO3溶液洗涤,再用蒸馏水洗涤,最后用无水CaCl2干燥、蒸馏,从而得到纯硝基苯;
(6)制备硝基苯是利用浓硝酸、浓硫酸和苯加热50-60°C生成硝基苯和水;
解答 解:(1)浓硫酸密度大于浓硝酸,应将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌,如果将浓硝酸加到浓硫酸中可能发生液体飞溅,
故答案为:浓硝酸;
(2)和普通分液漏斗相比,恒压滴液漏斗上部和三颈烧瓶气压相通,可以保证恒压滴液漏斗中的液体顺利滴下,
故答案为:可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下;
(3)长玻璃管作用是导气、冷凝回流,该实验中可以冷凝回流挥发的浓硝酸以及苯使之充分反应,减少反应物的损失,提高转化率,可用冷凝管或球形冷凝管或直行冷凝管替代,
故答案为:冷凝管(球形冷凝管或直行冷凝管均可);
(4)硝基苯是油状液体,与水不互溶,密度比水大,在下层,分离互不相溶的液态,采取分液操作,
故答案为:下;分液;
(5)用蒸馏水洗涤,硝基苯中含有水,用无水CaCl2干燥,然后将较纯的硝基苯进行蒸馏,得到纯硝基苯,故答案为:氯化钙;
(6)制备硝基苯是利用浓硝酸、浓硫酸和苯加热50-60°C生成硝基苯和水,反应的化学方程式为: ,
,
故答案为: ;
;
点评 本题主要考查硝基苯的制取、物质的分离方法等知识点,题目难度中等,为高考的高频题,试题综合性较强,知识点较全面,正确理解制备原理为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.

| A. | SiO32-+2CO2+2H2O→H2SiO3+2HCO3- | |
| B. | SiO2+2C$\stackrel{高温}{→}$Si+2CO↑ | |
| C. | SiH4$\stackrel{500℃}{→}$Si+2H2;CH4$\stackrel{>1000℃}{→}$C+2H2 | |
| D. | Si+O2$\stackrel{900℃}{→}$SiO2;C+O2$\stackrel{300℃}{→}$CO2 |
| A. | 苯和甲苯都能使酸性KMnO4溶液褪色 | |
| B. | 乙醚和乙酸都能与H2发生加成反应 | |
| C. | 蛋白质、油脂和糖类都可发生水解 | |
| D. | 乙醇和乙酸乙酯使用饱和Na2CO3溶液鉴别 |
a.取25mL NaOH溶液,向其中通入过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸此溶液1~2min;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程式:NaOH+CO2═NaHCO3、NaHCO3+NaOH═Na2CO3+H2O.
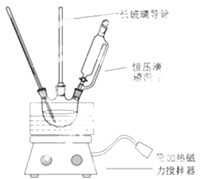
(2)煮沸溶液的目的是充分将溶液中的二氧化碳赶出.此方案第一步的实验装置如图所示:

(3)加入反应物前,如何检查整个装置的气密性用弹簧夹夹住A、B连接处,先检查A的气性:塞紧橡皮塞,从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,停止加水后,漏斗内与锥形瓶中的液面差保持不变,说明装置不漏气.然后检查B的气密性:向烧杯中注入少量水,使导管口侵入水中,双手捂住广口瓶片刻有气泡冒出,松开手后,有少量水进入导管形成水柱,说明装置不漏气(也可一次检查A、B的气密性:连接和烧杯间的乳胶管用止水夹夹住.然后从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,过一会,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气).
(4)装置B中盛放的试剂是饱和NaHCO3溶液,作用是吸收HCl气体.
(5)在实验室制法中,装置A还可作为下列②④⑤气体的发生装置(填序号).
①CH2=CH2 ②H2S ③CH4 ④CH≡CH ⑤H2
(6)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理并能用图所示装置进行处理的,将气体的序号填入装置图的下方空格内.
| 尾 气 吸 收 装 置 |  |  |
| 处理气体 | ①③ | ②④ |

已知:i.BaSO4(s)+2C(s)═2CO2(g)+BaS(s)△H1=+226.2kJ/mol
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
ii.某些物质的溶解度(g/100gH2O)简表
| 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | |
| Ba(OH)2•8H2O | 2.48 | 3.89 | 8.22 | 20.9 | 101 |
| NaOH | 98.0 | 109 | 129 | 174 | 314 |
| NaCl | 35.8 | 35.9 | 36.4 | 37.1 | 38.0 |
| BaCl2 | 33.5 | 35.8 | 40.8 | 46.2 | 52.5 |
(1)炭与重晶石直接反应的热化学方程式是:BaSO4(s)+4C(s)═BaS(s)+4CO(g)△H=+571.2kJ/mol.
(2)由BaCl2溶液可通过不同途径得到Ba(OH)2•8H2O.
途径1:BaCl2溶液$→_{过滤}^{Na_{2}CO_{3}固体}$固体1$\stackrel{灼烧}{→}$固体2$\stackrel{H_{2}O}{→}$Ba(OH)3.8H2O
①得到固体1的离子方程式是CO32-+Ba2+=BaCO3↓.
②固体2与水反应的化学方程式是BaO+9H2O=Ba(OH)2•8H2O.
途径2:BaCl2溶液$→_{操作}^{NaOH溶液}$Ba(OH)3.8H2O
途径2中的“操作”是加热浓缩,冷却结晶,过滤.依据上述溶解度简表分析,过滤时的最佳温度是20℃或常温;能从混合液中得到Ba(OH)2•8H2O晶体的原因是20℃时4种物质中Ba(OH)2•8H2O溶解度最小.
(3)若向滤液1中加入CuO粉末,可直接得到含Ba(OH)2•8H2O晶体和CuS的浊液,反应化学方程式是BaS+CuO+9H2O=Ba(OH)2•8H2O+CuS.将该浊液加热到80℃左右浓缩,趁热过滤,冷却滤液至室温,再过滤,即可得到Ba(OH)2•8H2O晶体.上述操作中趁热过滤的原因是减少过滤过程中Ba(OH)2•8H2O的损失.
| A. | 18 g H2O含有10NA个质子 | |
| B. | 1 mol/LCH3COONa溶液中含有1 mol/LCH3COO- | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |