题目内容
7.实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2↑+H2O
CH2═CH2+Br2-→BrCH2CH2Br
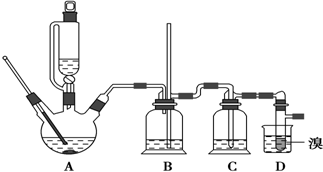
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚,用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母).
a.引发反应 b.加快反应速度c.防止乙醇挥发 d减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母).
a.水 b.浓硫酸c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”).
(5)若产物中有少量未反应的Br2,最好用b洗涤除去.(填正确选项前的字母)
a.水 b.氢氧化钠溶液c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
分析 (1)乙醇在浓硫酸140℃的作用下发生分子间脱水;
(2)浓硫酸具有强氧化性,可能氧化乙醇中的碳;
(3)乙烯和溴水发生了加成反应;
(4)根据1,2-二溴乙烷和水的密度相对大小解答;
(5)Br2可以和氢氧化钠发生氧化还原反应;
(6)利用1,2-二溴乙烷与乙醚的沸点不同进行解答;
(7)溴易挥发,该反应放热.
解答 解:(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚,故答案为:d;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,
故答案为:c;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,故答案为:溴的颜色完全褪去;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,
故答案为:下;
(5)常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,
故答案为:b;
(6)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,
故答案为:蒸馏;
(7)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,
故答案为:乙烯与溴反应时放热,冷却可避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
点评 本题主要考查了乙醇制备1,2-二溴乙烷,掌握相关物质的基本化学性质,是解答本题的关键,平时须注意积累相关反应知识,难度中等.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
11.实验室用浓盐酸与足量的二氧化锰反应产生少量的氯气.若反应过程中消耗了0.2mol HCl,理论上可收集到的氯气质量( )
| A. | 约等于3.55g | B. | 小于3.55g | C. | 大于3.55g | D. | 约等于7.1g |
2. 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用.
工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H1
下表所列数据是以上反应在不同温度下的化学平衡常数的数值:
(1)Ⅰ、在一密闭容器中发生反应并达到平衡后,保持其他条件不变,对容器升温,此反应的化学反应平衡应逆向移动(填“正向”、“逆向”、“不”)
Ⅱ、某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol/L,则CO的转化率为80%,此时的温度>250℃(填“>”、“<”、“=”)
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H1=-Q1kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-Q2 kJ/mol
③H2O(g)=H2O(l)△H3=-Q3 kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-(0.5Q1-0.5Q2-2Q3)kJ/mol
(3)某同学依据甲醇燃烧的反应原理,设计如右图所示的电池装置,工作一段时间后,测得溶液的pH将降低(填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:CH3OH-6e-+8OH-═CO32-+6H2O.
 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用.工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H1
下表所列数据是以上反应在不同温度下的化学平衡常数的数值:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
Ⅱ、某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol/L,则CO的转化率为80%,此时的温度>250℃(填“>”、“<”、“=”)
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H1=-Q1kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-Q2 kJ/mol
③H2O(g)=H2O(l)△H3=-Q3 kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-(0.5Q1-0.5Q2-2Q3)kJ/mol
(3)某同学依据甲醇燃烧的反应原理,设计如右图所示的电池装置,工作一段时间后,测得溶液的pH将降低(填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:CH3OH-6e-+8OH-═CO32-+6H2O.
12.某厂以重晶石(有效成分是BaSO4)为主要原料制取Ba(OH)2•8H2O晶体的示意图如下:

已知:i.BaSO4(s)+2C(s)═2CO2(g)+BaS(s)△H1=+226.2kJ/mol
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
ii.某些物质的溶解度(g/100gH2O)简表
回答下列问题:
(1)炭与重晶石直接反应的热化学方程式是:BaSO4(s)+4C(s)═BaS(s)+4CO(g)△H=+571.2kJ/mol.
(2)由BaCl2溶液可通过不同途径得到Ba(OH)2•8H2O.
途径1:BaCl2溶液$→_{过滤}^{Na_{2}CO_{3}固体}$固体1$\stackrel{灼烧}{→}$固体2$\stackrel{H_{2}O}{→}$Ba(OH)3.8H2O
①得到固体1的离子方程式是CO32-+Ba2+=BaCO3↓.
②固体2与水反应的化学方程式是BaO+9H2O=Ba(OH)2•8H2O.
途径2:BaCl2溶液$→_{操作}^{NaOH溶液}$Ba(OH)3.8H2O
途径2中的“操作”是加热浓缩,冷却结晶,过滤.依据上述溶解度简表分析,过滤时的最佳温度是20℃或常温;能从混合液中得到Ba(OH)2•8H2O晶体的原因是20℃时4种物质中Ba(OH)2•8H2O溶解度最小.
(3)若向滤液1中加入CuO粉末,可直接得到含Ba(OH)2•8H2O晶体和CuS的浊液,反应化学方程式是BaS+CuO+9H2O=Ba(OH)2•8H2O+CuS.将该浊液加热到80℃左右浓缩,趁热过滤,冷却滤液至室温,再过滤,即可得到Ba(OH)2•8H2O晶体.上述操作中趁热过滤的原因是减少过滤过程中Ba(OH)2•8H2O的损失.

已知:i.BaSO4(s)+2C(s)═2CO2(g)+BaS(s)△H1=+226.2kJ/mol
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
ii.某些物质的溶解度(g/100gH2O)简表
| 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | |
| Ba(OH)2•8H2O | 2.48 | 3.89 | 8.22 | 20.9 | 101 |
| NaOH | 98.0 | 109 | 129 | 174 | 314 |
| NaCl | 35.8 | 35.9 | 36.4 | 37.1 | 38.0 |
| BaCl2 | 33.5 | 35.8 | 40.8 | 46.2 | 52.5 |
(1)炭与重晶石直接反应的热化学方程式是:BaSO4(s)+4C(s)═BaS(s)+4CO(g)△H=+571.2kJ/mol.
(2)由BaCl2溶液可通过不同途径得到Ba(OH)2•8H2O.
途径1:BaCl2溶液$→_{过滤}^{Na_{2}CO_{3}固体}$固体1$\stackrel{灼烧}{→}$固体2$\stackrel{H_{2}O}{→}$Ba(OH)3.8H2O
①得到固体1的离子方程式是CO32-+Ba2+=BaCO3↓.
②固体2与水反应的化学方程式是BaO+9H2O=Ba(OH)2•8H2O.
途径2:BaCl2溶液$→_{操作}^{NaOH溶液}$Ba(OH)3.8H2O
途径2中的“操作”是加热浓缩,冷却结晶,过滤.依据上述溶解度简表分析,过滤时的最佳温度是20℃或常温;能从混合液中得到Ba(OH)2•8H2O晶体的原因是20℃时4种物质中Ba(OH)2•8H2O溶解度最小.
(3)若向滤液1中加入CuO粉末,可直接得到含Ba(OH)2•8H2O晶体和CuS的浊液,反应化学方程式是BaS+CuO+9H2O=Ba(OH)2•8H2O+CuS.将该浊液加热到80℃左右浓缩,趁热过滤,冷却滤液至室温,再过滤,即可得到Ba(OH)2•8H2O晶体.上述操作中趁热过滤的原因是减少过滤过程中Ba(OH)2•8H2O的损失.
19.己知:NH3•H2O(aq)与H2SO4(aq)反应生成1mol正盐的△H=-24.2kJ/mol;强酸、强碱的稀溶液反应的中和热的△H=-57.3kJ/mol.则NH3•H2O在水溶液中电离的△H等于( )
| A. | -69.4 kJ/mol | B. | -45.2kJ/mol | C. | +69.4 kJ/mol | D. | +45.2 kJ/mol |
17.下列有关实验的叙述中,正确的是( )
| A. | 红热的铁与水蒸气反应可生成氧化铁和氢气 | |
| B. | 将二氧化硫通入到紫色石蕊溶液中,溶液先变红后褪色 | |
| C. | 加热时,可将试管、蒸发皿、坩埚直接在酒精灯焰上加热 | |
| D. | 称量氢氧化钠固体时,应将氢氧化钠固体放在称量纸上称量 |