题目内容
【题目】写出下列反应的离子方程式:
(1)向Na2S2O3溶液中加入稀硫酸。_______________
(2)含有KI、H2SO4和淀粉的溶液,通入氧气后溶液变蓝__________
【答案】![]() + 2H+=S↓+ SO2↑+ H2O 4I- + O2 + 4H+=2I2 + 2H2O
+ 2H+=S↓+ SO2↑+ H2O 4I- + O2 + 4H+=2I2 + 2H2O
【解析】
Na2S2O3为强碱弱酸盐,与硫酸能发生复分解反应;在酸性溶液中,I-能被氧气氧化。
(1)向Na2S2O3溶液中加入稀硫酸,发生复分解反应,生成硫酸钠、硫、二氧化硫和水,反应的化学方程式为Na2S2O3+H2SO4==Na2SO4+ S↓+ SO2↑+ H2O,离子方程式为 ![]() + 2H+=S↓+ SO2↑+ H2O。答案为:
+ 2H+=S↓+ SO2↑+ H2O。答案为:![]() + 2H+=S↓+ SO2↑+ H2O;
+ 2H+=S↓+ SO2↑+ H2O;
(2)含有KI、H2SO4和淀粉的溶液,通入氧气后溶液变蓝,表明反应生成了I2,也即O2在酸性溶液中将I-氧化为I2,同时O2转化为H2O,反应的离子方程式为4I- + O2 + 4H+=2I2 + 2H2O。答案为:4I- + O2 + 4H+=2I2 + 2H2O。

【题目】有一无色透明溶液,欲确定是否含有下列离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,取该溶液的实验如下:
,取该溶液的实验如下:
实验步骤 | 实验现象 |
| 溶液变红色 |
| 有无色气体产生,气体遇空气可以变成红棕色 |
| 有白色沉淀生成 |
| 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断,下列说法正确的是![]()
A.根据实验![]() 可以确定溶液中不含有
可以确定溶液中不含有![]() 和
和![]() ,因为这二个离子相对应的酸为弱酸
,因为这二个离子相对应的酸为弱酸
B.溶液中一定存在的离子是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ;溶液中肯定不存在的离子是:
;溶液中肯定不存在的离子是:![]() 、
、![]() 、
、![]() 、
、![]()
C.为进一步确定其它离子,应该补充焰色反应的实验来检验![]() 就可以
就可以
D.通过实验![]() 和
和![]() 就可以确定溶液中一定含有
就可以确定溶液中一定含有![]() ,一定不含有
,一定不含有![]() 、
、![]() 、
、![]() ,所以实验步骤
,所以实验步骤![]() 的设计是错误的
的设计是错误的
【题目】Ⅰ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L 稀硫酸 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 4.0 |
2 | 3.0 | a | 2.0 | 2.0 | 5.2 |
3 | 3.0 | b | 2.0 | 1.0 | 6.4 |
(1)a=________,b=__________.根据上表中的实验数据,该组实验的结论_____________。
(2)①该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
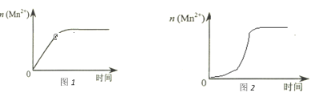
该小组同学提出的假设是___________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体X | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L 稀硫酸 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
固体X是__________。
③若该小组同学提出的假设成立,时间t__________4.0min(填>、=或<)。
Ⅱ.某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2、0.1mol·L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母abcdef...表示)。
物理量 实验序号 | V/mL[0.1 mol·L-1 Fe2(SO4)3] | ||||
1 | a | ||||
2 | a |
________________________。