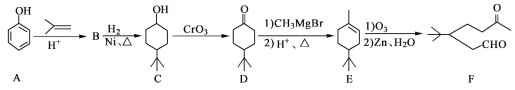
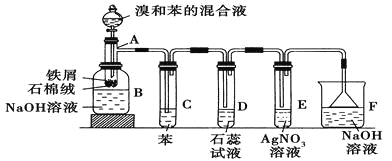
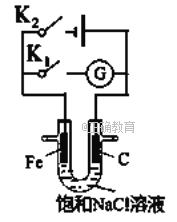
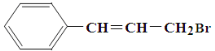题目内容
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化二氧化硫。下列说法正确的是( )

A.每活化一个氧分子吸收0.29 eV的能量
B.水可使氧分子活化反应的活化能降低0.42 eV
C.氧分子的活化是O—O键的断裂与C—O键的生成过程
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的反应物
【答案】C
【解析】
A.反应物的总能量高于生成物的总能量,因此每活化一个氧分子放出0.29 eV的能量,A错误;
B.化学反应过程中存在多步反应的活化能,整个反应的活化能较大者,根据能量图分析,整个反应的活化能为活化能较大者,则没有水加入的反应活化能为E=0.75 eV,有水加入的反应的活化能为E=0.57eV,所以水可使氧分子活化反应的活化能降低0.75 eV-0.57 eV=0.18 eV, B错误;
C.根据图象分析,氧分子活化过程O-O键断裂,生成C-O键,所以氧分子的活化是O-O的断裂与C-O键的生成过程,C正确;
D.活化氧可以快速氧化二氧化硫,而炭黑颗粒可以活化氧分子,因此炭黑颗粒可以看作大气中二氧化硫转化为三氧化硫的催化剂,D错误;
故合理选项是C。

【题目】将浓度均为0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
(资料)
该“碘钟实验”的总反应:H2O2 +2S2O32-+2H+=S4O62-+2H2O
反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是______。对于总反应,I-的作用相当于______。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是______。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液 (含淀粉) | H2O |
实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
实验Ⅲ | 5 | 2 | x | y | z |
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30 min、实验Ⅲ是40 min。
①实验Ⅲ中,x、y、z所对应的数值分别是______。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是______。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。
(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液(含淀粉) | H2O |
实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:_____________________。