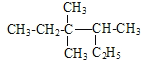题目内容
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是( )
A. 提高反应体系的温度,能降低该反应体系中SO2生成量
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g) ![]() 3CaSO4(s)+CaS(s) △H3,则△H3>△H2
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s)![]() CaO(s)+SO3(g)的焓变
CaO(s)+SO3(g)的焓变
【答案】B
【解析】分析:由已知的两个热化学方程式,结合温度对化学平衡的影响规律,即可分析A选项,根据自由能判据可分析B选项,利用盖斯定律可分析出C、D两个选项。
详解:A、只有在反应I中生成SO2,且该反应为吸热反应,所以升高温度,有利于反应I平衡向右移动,生成更多的SO2,故A错误;
B、要使反应II自发进行,则自由能判据△G=△H-T△S<0,已知△H2<0,由反应方程式可知该反应的熵变化不大,反应的自发性主要决定于焓变,所以该反应在低温下即可自发进行,且低温有利于节约能源,故B正确;
C、根据盖斯定律,反应II—4×反应I即得C选项的热化学方程式,所以△H3=△H2-4△H1,已知△H1>0,△H2<0,所以△H3<△H2,故C错误;
D、反应I和反应II中没有SO3(g),所以无法通过反应I和反应II计算出反应CaSO4(s)![]() CaO(s)+SO3(g)的焓变,故D错误。所以本题答案选B。
CaO(s)+SO3(g)的焓变,故D错误。所以本题答案选B。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案