题目内容
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着 Ba(OH)2溶液体积(V)的变化,沉淀的总物质的量(n)的变化如右图所示。则下列说法中正确的是( )
| A.a点的溶液呈中性 |
| B.b点发生反应的离子方程式是: Al3++2SO42-+2Ba2++3OH— = Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200mL |
| D.c点溶液呈碱性 |
D
解析试题分析:100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol。开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加,但增加幅度较前一过程小;所以a点的溶液呈酸性,故A错误;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液,沉淀达最大为BaSO4和Al(OH)3;继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液。由分析可知,b点发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,故B错误;由分析可知,c点加入Ba(OH)2的物质的量为0.005mol+0.02mol=0.025mol,所以0.025/0.1=250mL,故C错误;由分析可知,c为溶液为氨水与偏铝酸钡溶液,所以溶液呈碱性,故D正确,为本题的答案。
考点:镁铝及其化合物

常温下,下列各组离子在指定的水溶液中一定能大量共存的是
| A.使甲基橙变红的溶液:K+、Al3+、SO42-、NO3— |
| B.c(H+)=1×10—13mol·L—1的溶液:Na+、NH4+、SO42-、CO32- |
| C.c(Fe2+)=1.0 mol·L—1的溶液:H+、K+、Cl-、NO3— |
| D.含有大量Fe3+的溶液:Mg2+、Na+、SCN—、Cl— |
下列物质属于非电解质的是( )
| A.液氯 | B.三氧化硫 | C.硫酸 | D.蔗糖 |
下列离子方程式正确的是
| A.向次氯酸钙溶液通入SO2:Ca2++2ClO?+SO2+H2O=CaSO3↓+2HClO |
| B.向NH4A1(SO4)2溶液中滴入Ba(OH)2溶液恰使SO42-沉淀完全 NH4++Al3++2Ba2++2SO42-+4OH-=Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| C.向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O |
| D.向硝酸银溶液中滴加稀氨水至过量:Ag+ + NH3?H2O=AgOH↓ + NH4+ |
常温下,下列各组离子在指定溶液中可能大量共存的是
| A.0.1mol/LNaHSO4溶液中: K+、NH4+、HCO3—、NO3— |
| B.与铝反应产生氢气的溶液中:Na+、NH4+、SO42—、CH3COO— |
| C.滴加酚酞显红色的溶液中: Na+、NO3—、SO42—、CO32— |
| D.NaNO3溶液中: Fe2+、H+、Cl—、I— |
下列各组离子—定能大量共存的是( )。
| A.在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、H+ |
| B.在pH=12的溶液中:NH4+、Na+、(SO3)2-、Cl- |
| C.在强碱溶液中:Na+、K+、CO32-、NO3- |
D.在 c(H+)=0.1mol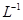 的溶液中:K+、I-、Cl-、NO3- 的溶液中:K+、I-、Cl-、NO3- |
某澄清透明溶液中只可能含有:
 中的几种,向该溶液中逐滴加人NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是( )
中的几种,向该溶液中逐滴加人NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是( )
| A.②⑤⑦ | B.②③⑤⑦ | C.③⑤⑦ | D.④⑤⑦ |
某溶液中可能含有Na+、NH4+.Ba2+、SO42-.I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是( )
| A.Na+ | B.SO42- | C.Ba2+ | D.NH4+ |
下列对于某些离子的检验及结论一定正确的是
| A.加入盐酸产生无色气体,将气体通入石灰水中,溶液变浑浊,一定有CO32- |
| B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
| C.滴加KSCN溶液后呈红色,一定有Fe3+ |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |