题目内容
下列离子方程式正确的是
| A.向次氯酸钙溶液通入SO2:Ca2++2ClO?+SO2+H2O=CaSO3↓+2HClO |
| B.向NH4A1(SO4)2溶液中滴入Ba(OH)2溶液恰使SO42-沉淀完全 NH4++Al3++2Ba2++2SO42-+4OH-=Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| C.向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O |
| D.向硝酸银溶液中滴加稀氨水至过量:Ag+ + NH3?H2O=AgOH↓ + NH4+ |
B
解析试题分析:A、次氯酸钙极易强氧化性,能把SO2氧化生成硫酸,A不正确;B、向NH4A1(SO4)2溶液中滴入Ba(OH)2溶液恰使SO42-沉淀完全,则NH4A1(SO4)2与Ba(OH)2的物质的量之比是1:2。由于OH-首先与Al3+结合生成氢氧化铝,然后再与NH4+结合,所以生成物是硫酸钡、氢氧化铝和氨水,B正确;C、氢氧化钠溶液过量,因此生成物是氢氧化镁、碳酸钠和水,C不正确;D、向硝酸银溶液中滴加稀氨水至过量得到银氨溶液,得不到氢氧化银沉淀,D不正确,答案选B。
考点:考查离子方程式的正误判断

某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:n(NO3-)︰n(SO42-)︰n(Fe3+)︰n(H+)︰n(X)=2︰3︰1︰3︰1,则X可能为
| A.Fe2+ | B.Mg2+ | C.Cl- | D.Ba2+ |
在给定的条件下,下列各离子组能大量共存的是
| A.滴加酚酞试液显红色的溶液 Fe3+、NH4+、Cl-、SCN- |
| B.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO-3、Br-、Ba2+ |
| C.pH=12的溶液 K+、ClO-、NO-3、H+ |
| D.pH=1的溶液 Cu2+、Na+、Mg2+、Cl- |
下列反应的离子方程式正确的是
| A.FeCl3溶液腐蚀铜板电路:Fe3+ +Cu = Fe2+ + Cu2+ |
| B.碳酸钙溶于醋酸溶液:CaCO3 + 2H+ = Ca2++CO2↑+H2O |
| C.Ba(OH)2溶液与稀硫酸反应:Ba2+ + SO42-=BaSO4↓ |
| D.铜与稀硝酸反应:3Cu + 2NO3- + 8H+ = 3Cu2++2NO↑+4 H2O |
对下列事实的解释,反应的化学方程式或离子方程式正确的是
| A.盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O |
| B.工业用FeCl3溶液腐蚀铜线路板:Fe3++Cu=Fe2++Cu2+ |
| C.酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
| D.食醋浸泡有水垢的暖壶或水壶,清除其中的水垢:2H++CaCO3=Ca2++H2O+CO2↑ |
下列离子在指定溶液中一定能大量共存的是
①加入Al能放出H2的溶液中:SO42-、Na+、K+、Cl-
②中性溶液:Mg2+、Fe3+、SO42-、Cl-(已知Ksp[Fe(OH)3]=2.6×10-39)
③由水电离的c(H+)=10-12mol/L的溶液中:Na+、K+、SO42-、HCO3-
④能使紫色石蕊变红的溶液中:Fe2+、NO3-、I-、Al3+
| A.③④ | B.②④ | C.①② | D.只有① |
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着 Ba(OH)2溶液体积(V)的变化,沉淀的总物质的量(n)的变化如右图所示。则下列说法中正确的是( )
| A.a点的溶液呈中性 |
| B.b点发生反应的离子方程式是: Al3++2SO42-+2Ba2++3OH— = Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200mL |
| D.c点溶液呈碱性 |
下列离子方程式正确的是
A.碳酸钙和盐酸反应:CO32-+2H+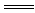 H2O+CO2↑ H2O+CO2↑ |
B.向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-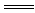 BaSO4↓ BaSO4↓ |
C.向稀盐酸溶液中加铁:3Fe+6H+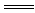 3Fe3++3H2↑ 3Fe3++3H2↑ |
D.向硝酸银溶液中加盐酸:Ag++C1-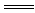 AgCl↓ AgCl↓ |
下列方程式正确的是( )
A.用氯胺处理自来水:NH2Cl+H2O NH2OH+HCl NH2OH+HCl |
| B.在含有Mg2+、HCO3-的自来水中加入过量的澄清石灰水: Ca2+ +Mg2+ +2OH- +2HCO3-=CaCO3↓+MgCO3↓+2H2O |
C.长时间煮沸含Mg2+、HCO3-的自来水:Mg2+ +2HCO3-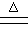 Mg(OH)2↓+2CO2↑ Mg(OH)2↓+2CO2↑ |
| D.Na2FeO4既是混凝剂、又可作消毒剂,作混凝剂的作用原理为: |