题目内容
某溶液中可能含有Na+、NH4+.Ba2+、SO42-.I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是( )
| A.Na+ | B.SO42- | C.Ba2+ | D.NH4+ |
A
解析试题分析:由①可知溶液显弱酸性,上述离子只有NH4+能水解使溶液显酸性,则一定含有NH4+,而S2-能水解显碱性,即S2-与NH4+不能共存于同一溶液中,则一定不含有S2-;再由氯水能氧化I-生成碘单质,而碘遇淀粉变蓝,而②中加氯水和淀粉无明显现象,则一定不含有I-;又溶液呈电中性,有阳离子必有阴离子,则溶液中有NH4+,必须同时存在阴离子,即SO42--必然存在,而Ba2+、SO42-能结合生成沉淀,则这两种离子不能共存,即一定不存在Ba2+;显然剩下的Na+是否存在无法判断,则需检验的离子是Na+,故选:A.
考点:离子共存问题;常见阳离子的检验;常见阴离子的检验

练习册系列答案
相关题目
在给定的条件下,下列各离子组能大量共存的是
| A.滴加酚酞试液显红色的溶液 Fe3+、NH4+、Cl-、SCN- |
| B.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO-3、Br-、Ba2+ |
| C.pH=12的溶液 K+、ClO-、NO-3、H+ |
| D.pH=1的溶液 Cu2+、Na+、Mg2+、Cl- |
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着 Ba(OH)2溶液体积(V)的变化,沉淀的总物质的量(n)的变化如右图所示。则下列说法中正确的是( )
| A.a点的溶液呈中性 |
| B.b点发生反应的离子方程式是: Al3++2SO42-+2Ba2++3OH— = Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200mL |
| D.c点溶液呈碱性 |
下列离子方程式正确的是
A.碳酸钙和盐酸反应:CO32-+2H+ H2O+CO2↑ H2O+CO2↑ |
B.向氢氧化钡溶液中加硫酸溶液:Ba2++SO42- BaSO4↓ BaSO4↓ |
C.向稀盐酸溶液中加铁:3Fe+6H+ 3Fe3++3H2↑ 3Fe3++3H2↑ |
D.向硝酸银溶液中加盐酸:Ag++C1- AgCl↓ AgCl↓ |
下列离子方程式正确的是( )。
A.三氯化铝溶液中加入过量氨水: |
B. 的NaAlO2溶液和 的NaAlO2溶液和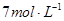 的HCI等体积互相均匀混合: 的HCI等体积互相均匀混合: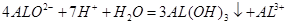 |
C.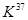 ClO3与浓盐酸(HCI)在加热时生成氯气: ClO3与浓盐酸(HCI)在加热时生成氯气: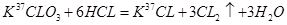 |
D.将25mL 0.l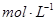 盐酸缓缓滴入25mL 0.1 盐酸缓缓滴入25mL 0.1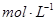 Na2CO3溶液中,并不断搅拌: Na2CO3溶液中,并不断搅拌: |
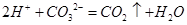
下列方程式正确的是( )
A.用氯胺处理自来水:NH2Cl+H2O NH2OH+HCl NH2OH+HCl |
| B.在含有Mg2+、HCO3-的自来水中加入过量的澄清石灰水: Ca2+ +Mg2+ +2OH- +2HCO3-=CaCO3↓+MgCO3↓+2H2O |
C.长时间煮沸含Mg2+、HCO3-的自来水:Mg2+ +2HCO3-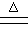 Mg(OH)2↓+2CO2↑ Mg(OH)2↓+2CO2↑ |
| D.Na2FeO4既是混凝剂、又可作消毒剂,作混凝剂的作用原理为: |
下列离子方程式书写正确的是
| A.铜屑中加入足量氯化铁溶液:Fe3++ Cu= Fe2++ Cu2+ |
| B.大理石中加入足量浓盐酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| C.硫酸溶液中加入足量氢氧化钡溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D.碳酸氢铵溶液中加入足量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
下列说法正确的是
| A.浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂 |
B.在任何条件下都不能发生Cu+H2SO4=CuSO4+H2 反应 反应 |
| C.浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气都首先发生置换反应 |
| D.二氧化氮与水反应的离子方程式是3NO2+H2O=2HNO3+NO |