题目内容
某澄清透明溶液中只可能含有:
 中的几种,向该溶液中逐滴加人NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是( )
中的几种,向该溶液中逐滴加人NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是( )
| A.②⑤⑦ | B.②③⑤⑦ | C.③⑤⑦ | D.④⑤⑦ |
A
解析试题分析:加入NaOH的量0~1mol,无沉淀生成,说明原溶液含H+,NaOH过量时,沉淀不溶解,说明原溶液不含Al3+,加入NaOH的量1~4mol,消耗的NaOH为3mol,生成沉淀的质量为100g,而3molNaOH与Mg2+反应,生成沉淀的质量小于100g,如果3molNaOH与Fe3+或Cu2+反应生成的Fe(OH)3或Cu(OH)2的质量大于100g,所以原溶液一定有Mg2+,Fe3+、Cu2+至少有1种;CO32?与Mg2+不能大量共存,原溶液中的阴离子只能是NO3?,故A项正确。
考点:本题考查图像的分析、离子反应的应用。

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.甲基橙呈红色的溶液:NH4+、Al3+、F-、Cl- |
| C.某无色溶液中:Al3+、HCO3-、Cl-、Br- |
| D.pH=12的溶液:K+、Na+、CH3COO-、Ag(NH3)2+ |
对下列事实的解释,反应的化学方程式或离子方程式正确的是
| A.盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O |
| B.工业用FeCl3溶液腐蚀铜线路板:Fe3++Cu=Fe2++Cu2+ |
| C.酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
| D.食醋浸泡有水垢的暖壶或水壶,清除其中的水垢:2H++CaCO3=Ca2++H2O+CO2↑ |
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着 Ba(OH)2溶液体积(V)的变化,沉淀的总物质的量(n)的变化如右图所示。则下列说法中正确的是( )
| A.a点的溶液呈中性 |
| B.b点发生反应的离子方程式是: Al3++2SO42-+2Ba2++3OH— = Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200mL |
| D.c点溶液呈碱性 |
下列离子方程式正确的是
A.碳酸钙和盐酸反应:CO32-+2H+ H2O+CO2↑ H2O+CO2↑ |
B.向氢氧化钡溶液中加硫酸溶液:Ba2++SO42- BaSO4↓ BaSO4↓ |
C.向稀盐酸溶液中加铁:3Fe+6H+ 3Fe3++3H2↑ 3Fe3++3H2↑ |
D.向硝酸银溶液中加盐酸:Ag++C1- AgCl↓ AgCl↓ |
下列离子方程式正确的是( )。
A.三氯化铝溶液中加入过量氨水: |
B. 的NaAlO2溶液和 的NaAlO2溶液和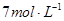 的HCI等体积互相均匀混合: 的HCI等体积互相均匀混合: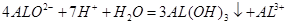 |
C.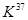 ClO3与浓盐酸(HCI)在加热时生成氯气: ClO3与浓盐酸(HCI)在加热时生成氯气: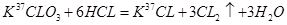 |
D.将25mL 0.l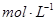 盐酸缓缓滴入25mL 0.1 盐酸缓缓滴入25mL 0.1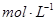 Na2CO3溶液中,并不断搅拌: Na2CO3溶液中,并不断搅拌: |
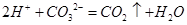
下列离子方程式正确的是( )
| A.NaHSO3溶液中投入过氧化钠粉末:4HSO3- +2Na2O2 = 4SO32- + O2↑ + 4Na+ |
| B.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O==AlO2-+4NH4++2H2O |
| C.氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| D.将1 mol/L NaAlO2溶液和1.5 mol/L HCl溶液等体积互相均匀混合: |
下列说法正确的是
| A.浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂 |
B.在任何条件下都不能发生Cu+H2SO4=CuSO4+H2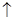 反应 反应 |
| C.浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气都首先发生置换反应 |
| D.二氧化氮与水反应的离子方程式是3NO2+H2O=2HNO3+NO |
