题目内容
下列说法正确的是
| A.镁、铝、铜、铁、钠五种元素中,铜和铁均为副族元素 |
| B.10Be和9Be是中子数不同质子数相同的同种核素 |
| C.元素X位于元素Y的上一周期,X原子得电子能力强于Y原子 |
| D.短周期的同主族元素原子序数差值可能为2、8、10 |
D
解析试题分析:A、铁是第Ⅷ族元素,不是副族,A不正确;B、10Be和9Be是中子数不同质子数相同的不同种核素,二者互为同位素,B不正确;C、元素X位于元素Y的上一周期,氮X原子得电子能力不一定强于Y原子,例如钠是第三周期元素,F是第二周期元素,F的得电子能力强于Na的,C不正确;D、由于周期表中每一周期含有的元素种类分别是2、8、8、18、18、32、32(排满后),所以短周期的同主族元素原子序数差值可能为2、8、10,D正确,答案选D。
考点:考查元素周期表的结构、核素和同位素、得电子能力比较等

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
短周期元素X、Y、W、Q在元素周期表中的相对位置如下图所示。常温下,Al能溶于W 的最髙价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是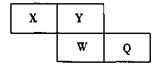
| A.Y的最髙化合价为+6 |
| B.离子半径:W>Q>Y>X |
| C.氢化物的沸点:Y>Q |
| D.最髙价氧化物的水化物的酸性:W>Q |
很多国家已停止使用含铊的杀虫剂。元素周期表中铊的数据见右图,下列说法正确的是
| A.TI元素是一种主族元素 |
| B.TI元素的相对原子质量是204 |
| C.铊元素的质量数是204.4 |
| D.TI原子最外层有3个能量相同的电子 |
已知元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,
下列关系正确的是
| A.质子数c>b | B.离子还原性Y2->Z- |
| C.氢化物稳定性H2Y>HZ | D.原子半径X<W |
下列说法错误的是
| A.H2O2和Na2O2都属于氧化物,两种物质中所含的化学键类型完全相同 |
| B.原子核外在离核较远区域的电子易失去,其原因是这些电子能量较高 |
| C.第三周期非金属元素形成氢化物的稳定性从左到右逐渐增强 |
| D.在周期表的金属元素和非金属元素的交界处寻找半导体,在过渡元素区中寻找催化剂 |
下列各组物质的性质比较,正确的是( )
| A.熔点:CO2<H2O<SiO2<KCl |
| B.粒子半径:K+>Na+>Mg2+>Al3+ |
| C.酸性:H3PO4>H2SO4>HClO4>H2SiO3 |
| D.稳定性:H2O<NH3<PH3<SiH4 |
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则
| A.原子半径:丙>乙>丁 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
几种短周期元素的原子半径及主要化合价如下表 ( )
| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
下列叙述错误的是(其中NA表示阿伏加德罗常数的值)
A.X、N元素的金属性:X>N
B.Y、M元素形成的离子化合物是工业冶炼Y的原料
C.X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子
D.标准状况下1L 1mol·L-1的YP3溶液中含有NA个Y3+离子
下图为元素周期表中短周期的一部分,下列说法正确的是
| ① | ② | ③ |
| ④ | ⑤ | ⑥ |
A.①~⑥可能全部是非金属元素
B.对应单质的活泼性:②>③
C.④的最高价氧化物对应的水化物可能为两性物质
D.②、⑤的最高价氧化物对应的水化物可能均为强酸