题目内容
几种短周期元素的原子半径及主要化合价如下表 ( )
| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
下列叙述错误的是(其中NA表示阿伏加德罗常数的值)
A.X、N元素的金属性:X>N
B.Y、M元素形成的离子化合物是工业冶炼Y的原料
C.X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子
D.标准状况下1L 1mol·L-1的YP3溶液中含有NA个Y3+离子
D
解析试题分析:根据元素的主要化合价进行归类,X、N化合价为+1价,可以推断出X、N均处于ⅠA,Y处ⅢA,Z处于ⅤA,M为-2价,那么应处于ⅥA,只能是O元素,S还有+4、+6价。P应处于ⅦA,只能是Cl元素,F只有-1价。再根据原子半径大小关系,同周期从左到右原子半径逐渐减小,同主族从上打下逐渐增大,可以判断,N是Li元素,不可能是H元素(H原子半径最小),X是Na元素。同周期原子半径从左到右逐渐减小,同时结合主要化合价进行考虑可以得出:Y是Al元素(只有正价),Z是N元素,不可能是P元素,因为氧元素下一周期的半径会大于Z元素。所以综上可以得出各元素分别为:X是Na元素,Y是Al元素,Z是N元素,M是O元素,N是Li元素,P是Cl元素。A.同主族金属性从上到下逐渐增强,所以金属性应有Na>Li。故A正确。B.工业上冶炼Al元素是采用电解Al2O3(加入冰晶石降低熔点)故B正确。C.Na在O2中燃烧生成Na2O2,1mol Na2O2含有1mol O22-,39g Na2O2为0.5mol。故C正确。D.1molAlCl3溶液中,Al3+会发生水解,所以Al3+<NA。
考点:元素周期表及周期律,常见金属及其化合物,NA的判断

下列元素中非金属性最强的是
| A.氯 | B.氧 | C.氟 | D.溴 |
下列说法正确的是
| A.镁、铝、铜、铁、钠五种元素中,铜和铁均为副族元素 |
| B.10Be和9Be是中子数不同质子数相同的同种核素 |
| C.元素X位于元素Y的上一周期,X原子得电子能力强于Y原子 |
| D.短周期的同主族元素原子序数差值可能为2、8、10 |
已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法下正确的是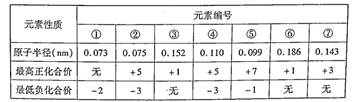
| A.⑦的简单离子不是同周期元素离子半径最小的 |
| B.气态氢化物的稳定性①>② |
| C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏 |
| D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥ |
X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时,0.1mol/L X和W形成化合物的水溶液pH为1。下列说法正确的是
| A.由于非金属性Y>R,所以X、Y组成化合物的沸点高于X、R组成的化合物 |
| B.Y和其他四种元素均可形成至少两种的二元化合物 |
| C.RY2能与Y、Z形成的一种化合物反应生成Y2 |
| D.Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
短周期金属元素甲-戊在元素周期表中的相对位置如表所示,下面判断正确的是( )
| 甲 | 丙 | |
| 乙 | 丁 | 戊 |
A.原子半径: 丙<丁<戊
B.金属性:丙>甲
C.最高价氧化物对应的水化物碱性:乙>丁>戊
D.戊只与强酸反应
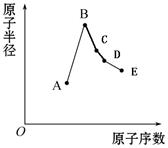
同一短周期内主族元素最高价氧化物对应水化物相同浓度稀溶液的pH与原子半径的关系如图,下列说法正确的是
| A.原子序数:W>Z>X |
| B.气态氢化物的稳定性:N>R |
| C.Y和W形成共价化合物 |
| D.X和Z两者最高价氧化物对应的水化物能相互反应 |
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价。下列说法正确的是
| A.XH4的沸点比YH3高 |
| B.X与W形成的化合物和Z与W形成的化合物的化学键类型相同 |
| C.元素W的最高价氧化物对应水化物的酸性比Y的强 |
| D.X与Y形成的化合物的熔点可能比金刚石高 |