题目内容
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则
| A.原子半径:丙>乙>丁 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
A
解析试题分析:甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,甲为H、乙为N,甲和丙同主族,丙为Na,第三周期丁原子最外层电子数与电子层数相等,丁为Al。A、原子半径:Na>Al>N,错误;B、单质的还原性:Na>Al>H,错误;C、钠的氧化物是离子化合物,错误;D、乙、丙、丁的最高价氧化物对应的水化物分别为HNO3、NaOH、Al(OH)3,能相互反应,故正确。
考点:考查元素推断、元素及其化合物性质、周期律相关知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列大小关系比较正确的是
| A.离子半径:F-<Na+<Mg2+ |
| B.电负性:C<O<N |
| C.氢化物的沸点:NH3<PH3<AsH3 |
| D.碱性: NaOH>Mg(OH)2> Al(OH)3 |
依据元素周期表及元素周期律,下列推断正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
| D.主族元素的最高正化合价等于该元素原子的最外层电子数 |
下列说法正确的是
| A.镁、铝、铜、铁、钠五种元素中,铜和铁均为副族元素 |
| B.10Be和9Be是中子数不同质子数相同的同种核素 |
| C.元素X位于元素Y的上一周期,X原子得电子能力强于Y原子 |
| D.短周期的同主族元素原子序数差值可能为2、8、10 |
已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法下正确的是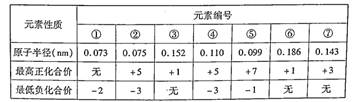
| A.⑦的简单离子不是同周期元素离子半径最小的 |
| B.气态氢化物的稳定性①>② |
| C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏 |
| D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥ |
X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时,0.1mol/L X和W形成化合物的水溶液pH为1。下列说法正确的是
| A.由于非金属性Y>R,所以X、Y组成化合物的沸点高于X、R组成的化合物 |
| B.Y和其他四种元素均可形成至少两种的二元化合物 |
| C.RY2能与Y、Z形成的一种化合物反应生成Y2 |
| D.Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
短周期金属元素甲-戊在元素周期表中的相对位置如表所示,下面判断正确的是( )
| 甲 | 丙 | |
| 乙 | 丁 | 戊 |
A.原子半径: 丙<丁<戊
B.金属性:丙>甲
C.最高价氧化物对应的水化物碱性:乙>丁>戊
D.戊只与强酸反应
关于元素周期表的说法正确的是( )
| A.元素周期表有8个主族 | B.元素周期表有7个周期 |
| C.短周期是指第一、二周期 | D.第IA族的元素全部是金属元素 |
下图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是
| A.N、Z两种元素的离子半径相比前者较大 |
| B.M、N两种元素的气态氢化物的稳定性相比后者较强 |
| C.X与M两种元素组成的化合物能与碱反应,但不能与任何酸反应 |
| D.工业上常用电解Y和N形成的化合物的熔融态制取Y的单质 |